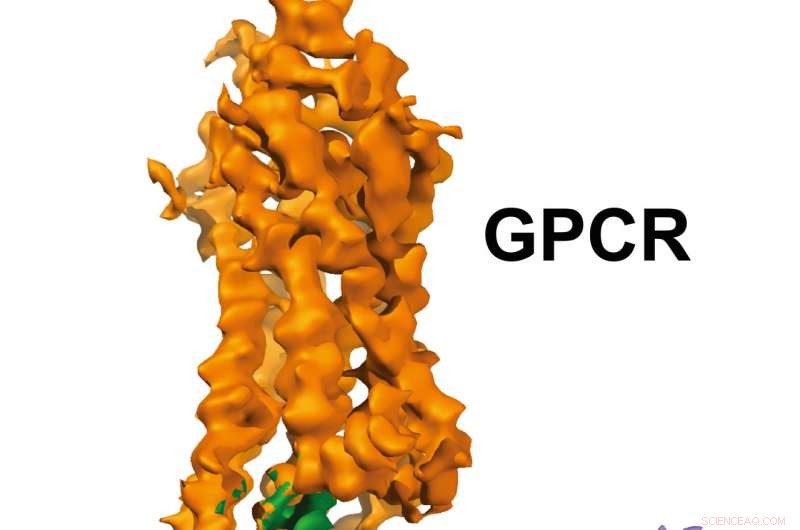
GPCR-Gi-struktur. Upphovsman:Xu Laboratory, Van Andel Research Institute
För första gången, forskare har visualiserat samspelet mellan två kritiska komponenter i kroppens stora mobilnätverk, en upptäckt som kan leda till effektivare mediciner med färre biverkningar för tillstånd som sträcker sig från migrän till cancer.
Bilderna nära atomupplösning, publicerad idag i Natur , visa en G-proteinkopplad receptor (GPCR) kallad rhodopsin bunden till ett hämmande G-protein, och ger en plan för att designa mer exakt, selektiva läkemedel och samtidigt lösa ett mångårigt problem på området.
"Genom att visualisera detta komplex löses ett saknat kapitel i GPCR -historien genom att äntligen avslöja hur dessa två molekyler interagerar i utsökt detalj, "sade H. Eric Xu, Ph.D., en professor vid Van Andel Research Institute (VARI) och en av studiens ledande författare. "Allt inom biologin är baserat på molekylära interaktioner så ju mer vi vet om hur strukturerna i dessa två molekyler fungerar tillsammans, desto bättre position har vi för att utforma förbättrade mediciner med färre oönskade effekter. "
Dagens resultat gjordes möjliga genom användning av en revolutionerande teknik som kallas kryo-elektronmikroskopi (cryo-EM), som gör det möjligt för forskare att se svårt att visualisera molekyler i häpnadsväckande klarhet.
"Användningen av cryo-EM-teknik för att erhålla strukturinformation om viktiga farmaceutiska mål som GPCR i olika stater visar att vi nu har möjlighet att tillämpa dessa metoder för applikationer för upptäckt av läkemedel, "sa Sriram Subramaniam, Ph.D., en utredare vid National Cancer Institute of the National Institutes of Health och en senior författare till studien.
Inbäddad i cellmembranet, GPCR fungerar som ledningar mellan en cell och dess omgivning, interagerar med G -proteiner och andra signalmolekyler som kallas arrestiner för att förmedla viktiga budskap till och från cellen som reglerar en rad fysiologiska funktioner, inklusive tillväxt, immunsvar och sensorisk uppfattning.
När den är kopplad till GPCR, hämmande G -proteiner reglerar produktionen av sekundära kemiska budbärare som har effekter i hela kroppen, från interaktioner med serotoninreceptorer i hjärnan och tarmen, som hjälper till att reglera humör och aptit, till interaktioner med dopaminreceptorer i hjärnan, som styr belöningssvar och frivillig rörelse, bland många andra.
Dessa omfattande interaktioner med G-proteiner och arrestiner, tillsammans med deras tillgänglighet på utsidan av cellen, göra GPCR till attraktiva mål för terapeutisk utveckling. För närvarande, mer än 30 procent av medicinerna på marknaden fungerar genom att interagera med GPCR.
"Informationen som avslöjas av våra resultat hjälper till att underlätta utformningen av en ny generation mediciner, "sa Yanyong Kang, Ph.D., en forskare vid Xu Laboratory och medförfattare till studien. "Eftersom detta är det första GPCR-hämmande G-proteinkomplexet som är strukturellt bestämt, vi tror att våra metoder kommer att leda till karakterisering av andra viktiga, ännu svårt att visualisera GPCR:er. "
De 3D-bilder som genereras av teamet avslöjar en specialiserad helix i slutet av det inhiberande G-proteinet som fungerar som en strukturell signatur, vilket hjälper GPCR som rhodopsin att skilja mellan hämmande G -proteiner och en annan typ av G -protein som kallas ett stimulerande G -protein.
Dagens resultat är de senaste i en serie av första för Xu och hans team, som inkluderar ett landmärke 2015 Natur studie som först beskrev strukturen av rhodopsin och arrestin i komplex tillsammans. Detta jobb, som hyllades som ett stort genombrott på området, fick Xu Hans Neurath Award från The Protein Society och Hans Neurath Foundation 2016.
I en uppföljningsstudie publicerad i Cell år 2017, Xu och hans medarbetare förfinade ytterligare sin tidigare struktur av komplexet rhodopsin-arrestin, och avslöjade en uppsättning fosforyleringskoder som dikterar sammansättningen av GPCR-arrestinkomplex.
GPCR är notoriskt svåra att visualisera med traditionella röntgenkristallografimetoder; hittills, endast 40 av mer än 800 totala GPCR har fått sina strukturer bestämda, inklusive Xus rhodopsin-arrestinkomplex.
För att bestämma dagens struktur, laget utnyttjade VARI:s kraftfulla Titan Krios kryo-elektronmikroskop, som kan avbilda molekyler 1/10, 000:e bredden på ett människohår och kan lättare visualisera molekyler som GPCR:er som är inbäddade i cellmembranet. Institutets Krios, som är en del av sin David Van Andel Advanced Cryo-Electron Microscopy Suite, är ett av färre än 120 sådana mikroskop i världen.
Subramaniam och hans team har varit föregångare i användningen av cryo-EM för att bestämma några av de högsta upplösningsstrukturer som hittills rapporterats med cryo-EM, inklusive flera kliniskt relevanta ligand-proteinkomplex.