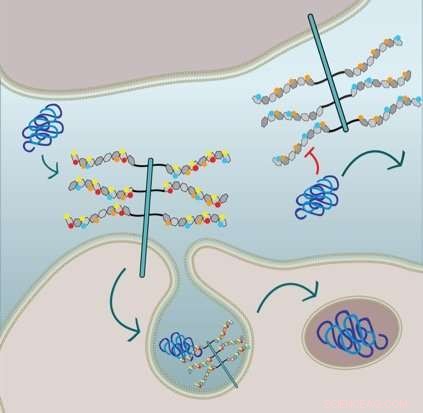
Figuren visar att upptagning av cellulär taufibril kräver 6-O-sulfatering och N-sulfatering av HSPG-sidokedjorna:Cellen i den nedre halvan uttrycker HSPG med alla sulfatgrupper och internaliserar tau via makropinocytos. Cellen i den övre halvan är genetiskt modifierad och saknar N-sulfation (röda cirklar) och 6-O-sulfation (gula cirklar) och därmed, taufibrillupptagningen hämmas. Upphovsman:Sandi Jo Estill-Terpack, Barbara Stopschinsky
Vampyrer kan göra människor till vampyrer, men att komma in i en människas hus, de måste bjudas in. Forskare vid UT Southwestern Medical Center, skriver i Journal of Biological Chemistry , har avslöjat detaljer om hur celler inbjuder inuti skadade proteiner som kan göra normala proteiner korrupta, som leder till neurodegenerativa sjukdomar såsom Alzheimers och Parkinsons sjukdomar. Att förstå de molekylära detaljerna om hur dessa proteiner sprider sig från cell till cell kan leda till behandlingar för att stoppa sjukdomsprogressionen.
Alzheimers och Parkinsons är associerade med särskilda proteiner i hjärnans felviktning, aggregera, och att få normala proteiner att fälla ihop och aggregera. Marc Diamonds grupp vid UT Southwestern upptäckte 2013 att för att komma in i nya celler och sprida felfällning, de sjukdomsassocierade proteinerna tau, alfa-synuklein och amyloid-beta måste binda till en typ av sockerproteinmolekyl som kallas heparansulfatproteoglykan (HSPG) på cellens yta. Denna bindning utlöser cellen att föra in det skadade proteinet inuti. I den nya studien, gruppen försökte förstå mer om hur denna process fungerade.
"Frågan var, hur specifik är denna (process)? Eller är det inte specifikt alls? "Frågade Barbara Stopschinski, läkaren och forskaren i Diamond's lab som övervakade det nya arbetet. Vad var detaljerna i den kemiska kommunikationen mellan HSPG och tau som utlöste taus inträde i cellerna? Och var denna process annorlunda för alfa-synuklein (associerad med Parkinsons sjukdom), amyloid-beta och tau (båda associerade med Alzheimers sjukdom)?
HSPG kan ha olika storlekar och strukturer; de kan dekoreras med olika mönster av sockerarter, och sockerarterna kan själva innehålla olika mönster av svavelinnehållande grupper (sulfatgrupper). Stopschinski testade systematiskt hur olika mönster av sulfatgrupper påverkade bindningen och upptaget i celler av alfa-synuklein, amyloid-beta och tau.
Hon fann att felviken tau kunde komma in i celler endast genom en mycket specifikt dekorerad och modifierad HSPG. Amyloid-beta och alfa-synuklein, å andra sidan, var mer flexibla i de typer av sulfatgrupper som utlöste deras upptag. Vidare, Stopschinski identifierade enzymerna i cellerna som skapade särskilda sulfationsmönster i HSPG. När dessa enzymer togs bort, felveckad tau togs inte längre upp i celler, förmodligen för att HSPG sockerdekorationer och sulfationsmönster förändrades, vilket betyder att fel tau inte längre visste det molekylära lösenordet.
Teamet vill nu förstå om dessa processer fungerar på samma sätt i hjärnan som de gör i kulturer av hjärnceller. Diamond hoppas att förstå hur korrupta proteiner rör sig mellan hjärnceller kommer att leda till sätt att stoppa dem.
"Det är något mycket anmärkningsvärt med hur effektivt en cell tar upp dessa aggregat, ta in dem och använd dem för att göra mer, "Diamond sa." Denna kunskap har viktiga konsekvenser för vår förståelse av hur neurodegenerativa sjukdomar blir värre med tiden. Eftersom vi har identifierat specifika enzymer som kan hämmas för att blockera denna process, detta kan leda till nya terapier. "