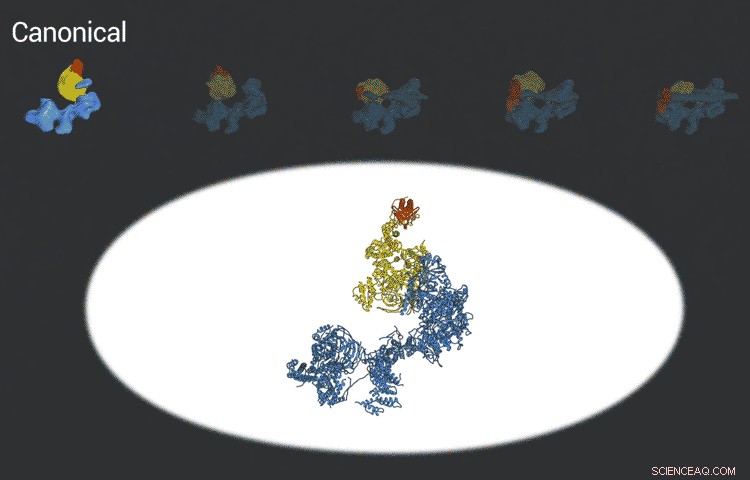
Transkriptionsfaktor IID -komplexet låser sig på DNA, kontrollerar att det är på rätt plats och rekryterar sedan andra proteiner för att börja transkribera DNA till RNA. Nya framsteg inom cryo-EM gjorde det möjligt för forskare att definiera fem olika konformationer av TFIID när den låses och laddas. Upphovsman:Eva Nogales lab
Skjuta gränserna för kryo-elektronmikroskopi, University of California, Berkeley, forskare har fångat frysramar av den förändrade formen av en enorm molekyl, en av kroppens nyckelmolekylära maskiner, när det låser sig på DNA och laddar maskiner för att läsa den genetiska koden.
Molekylen, kallas transkriptionsfaktor IID, är avgörande för att transkribera gener till RNA som senare kommer att användas som ritningar för att tillverka proteiner. På grund av dess många rörliga delar och stora storlek, dock, TFIIDs 3D-struktur har varit svår att fånga:de rörliga delarna blir suddiga.
Cryo-EM, en bildteknik vars upptäckare fick Nobelpriset i kemi 2017, är det enda sättet att få en ögonblicksbild av skrymmande, diskettstrukturer som detta. Högupplöst strukturell information är avgörande för att förstå hur TFIID översätter bruksanvisningen i vårt genom och hur det ibland går på tok.
Den nya, mer detaljerade ögonblicksbilder av molekylens rörliga delar kan hjälpa läkemedelsdesigners att skapa läkemedel som stör molekylens strukturella förändringar för att justera uttrycket av en gen som orsakar sjukdom.
"Dessa strukturer ger dig potential att rationellt designa små molekyler som kommer att störa den normala funktionen, för nu har vi inte bara en enda struktur, vi har många strukturer, vilket är ännu kraftfullare eftersom vi kan rikta in den rörelse som vi ser just nu, sa Eva Nogales, en UC Berkeley professor i molekylär och cellbiologi och en fakultetsvetare vid Lawrence Berkeley National Laboratory.
Nogales och hennes kollegor, mest framträdande UC Berkeley doktorander Avinash Patel och Robert Louder, publicerade sina fynd online i veckan före tryckt publicering i tidningen Vetenskap .
"Var du klibbar det läkemedlet och hur du får det läkemedlet att fungera är mycket beroende av dessa strukturers övergående natur, och det är något vi har insett först mycket nyligen, "sa Robert Tjian, en UC Berkeley professor i molekylär och cellbiologi som upptäckte TFIID och har arbetat med molekylen under stora delar av sin karriär, även om han inte var medförfattare till den nya tidningen. "Eftersom dessa molekyler rör sig och deras strukturer är så komplicerade, konventionell läkemedelsupptäckt skulle aldrig avslöja vad som händer. Evas strukturer kommer att förändra det. Detta har potential att öppna upp universum av drogbara mål. "
Frysning av molekyler
TFIID är en tätort av mer än ett dussin distinkta proteiner som finns på en promotor - en region av DNA som styr transkriptionen av en närliggande gen - och testar sekvensen för att se till att den har landat på rätt plats. När detta är bekräftat, det öppnar upp för att rekrytera dussintals andra proteiner som sedan börjar ratcheting längs genen, använder DNA -sekvensen som en mall för att skapa en komplementär sekvens av RNA, kallas budbärar -RNA. Detta vänder sig sedan ut ur kärnan in i cellens kropp, där det översätts av andra molekylära maskiner till protein.
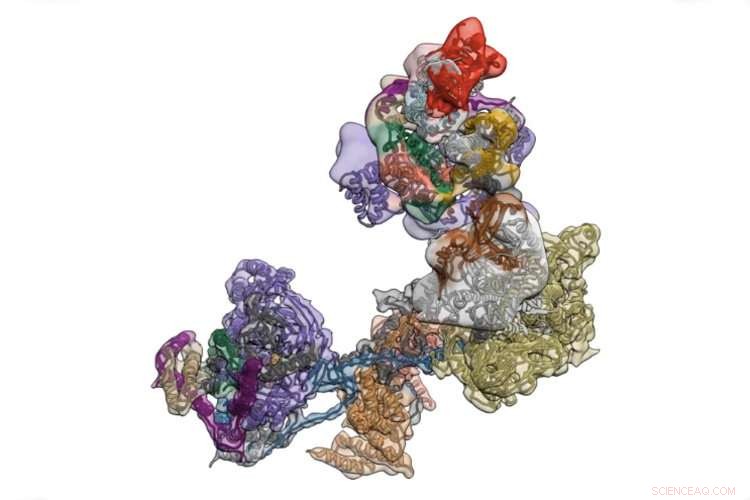
TFIID är ett komplex av proteiner som initierar transkription av kroppens bruksanvisning kodad i DNA. Upphovsman:University of California - Berkeley
"TFIID är förmodligen den svåraste strukturen någon har försökt lösa, eftersom den är massiv och är mycket flexibel, "sa Tjian." Det enda sättet du kan se dessa mycket flexibla strukturer är genom cryo-EM, och Eva kan nu frysa alla dessa olika flexibla tillstånd och beskriva rörelsen. "
Cryo-EM innebär att man fryser en droppe som innehåller miljontals kopior av en molekyl, i alla tänkbara riktningar, och att använda ett elektronmikroskop för att bestämma strukturen genom att kombinera bilder för att definiera 3D-formen. Eftersom TFIID har många rörliga delar eftersom det binder till DNA och gör sig redo att transkribera en gen, Medelvärdet av alla frysta positioner ger en suddig bild.
Nogales jämför tidigare ansträngningar för att avbilda TFIID, inklusive hennes egna försök som går nästan 20 år tillbaka i tiden, att ta ett fotografi av ett fotbollslag på planen och i genomsnitt ta fram alla spelares rörelser. Resultatet är en generisk mänsklig bål med suddigt huvud och lemmar.
Imaging fotbollsplanen
Nu, tack vare mer än två års intensivt arbete av Patel och Louder, det är möjligt att fånga bilder med högre upplösning som liknar att skilja en anfallares benspark från målvaktens handblock och en back på huvud.
"Tänk dig att du har en bild av de 22 fotbollsspelarna på planen, och du skulle kombinera dem till en enda enhet som du skulle kalla 'den generiska fotbollsspelaren, "sa hon." Det kommer att se ut som en suddig bild - du kunde knappt se att det är en humanoid form och att det finns någon form av rörelse, men du skulle inte inse att det finns en skillnad mellan spelarna. "
De förbättrade bilderna är ett resultat av bättre detektorer som ursprungligen utvecklades av kollegor på Berkeley Lab, and steadily improving computer algorithms to analyze the huge amounts of data collected by the detectors. This helped Nogales and her team to define five distinct structures of the TFIID molecule.
"They span the whole binding sequence:before binding to the DNA, initial binding to the promoter, subsequent binding after it double checks that this is the right place, and the final state, " Nogales said.
She and her colleagues continue to push the limits of cryo-EM, hoping to determine the 3-D structure of TFIID after other transcription proteins land on it to complete the transcription process.