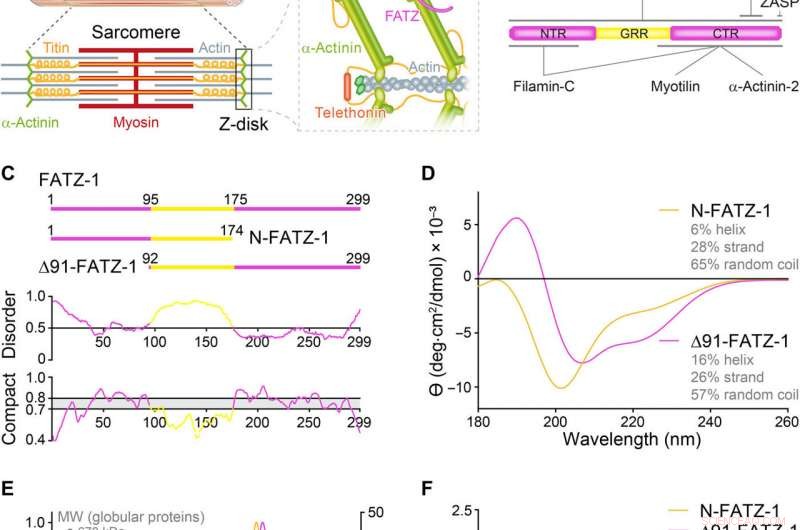
Proteiner från FATZ -familjen uppvisar inneboende störning. (A) Schema över den strimmade muskelsarkomeren och närbild av F-aktin/α-aktinin/FATZ-interaktioner i Z-disk. (B) Schema över FATZ-1-interaktom och bindningsställen som hittills rapporterats. (C) Schema över de viktigaste FATZ-1-konstruktionerna, tillsammans med deras aminosyragränser och domänkomposition. Förutsägda störda regioner (över 0,5) och kompaktitet (över 0,8) visas nedan. (D) Circular dichroism (CD) spectra of N-FATZ-1 and Δ91-FATZ-1, tillsammans med beräknat sekundärt strukturinnehåll. (E) Storleksexklusionskromatografi (SEC) –multiangle light scattering (MALS) analys av N-FATZ-1 och Δ91-FATZ-1, ger molekylvikter (MW) på 21 och 24 kDa, respektive. Elueringsvolymerna var lägre än förväntat i förhållande till globulära standarder [tyroglobulin (670 kDa), γ-globulin (158 kDa), ovalbumin (44 kDa), och myoglobin (17 kDa)], motsvarande MW på 50 och 46 kDa för N-FATZ-1 och Δ91-FATZ-1, respektive. UV, ultraviolett. (F) Dimensionslösa Kratky-tomter av N-FATZ-1 och Δ91-FATZ-1, samt av globulärt bovint serumalbumin (BSA) (SASBDB -kod SASDFQ8). Experimentell SEC – liten vinkel röntgenspridning (SAXS) data för N-FATZ-1 (G) och Δ91-FATZ-1 (I) och motsvarande anpassning till data från utvalda ensembler erhållna från Ensemble Optimization Method (EOM). Rg -fördelningar för utvalda ensembler i förhållande till fördelningen av en slumpmässig pool visas i insatserna. Modellrepresentanter för de utvalda EOM-ensemblerna för N-FATZ-1 (H) och Δ91-FATZ-1 (J), tillsammans med deras Rg (i nanometer) och volymfraktioner (i procent). Upphovsman:Science Advances, doi:10.1126/sciadv.abg7653
Alfa-aktinin kan tvärbinda aktinfilament och förankra dem till Z-skivan i sarkomerer. Sarkomerer är en strukturell enhet av myofibril i strimmig muskel. FATZ (filamin, a-aktinin- och teletoninbindande protein i Z-skivan) kan interagera med α-aktinin och andra kärn-Z-skivproteiner som bidrar till myofibrils montering och underhåll. I en ny rapport nu Vetenskapliga framsteg , Antonio Sponga och ett internationellt forskargrupp i Österrike, Tyskland, Ryssland, Polen och Storbritannien detaljerade den första strukturen och cellvalideringen av α-actinin-2-komplexet med en Z-disk-partner, FATZ-1, att bilda en konform ensemble. FATZ-1 bildade ett tätt flummigt komplex med a-aktinin-2 med en föreslagen interaktionsmekanism via molekylära igenkänningselement och sekundära bindningsställen. Den erhållna integrativa modellen avslöjade en polar arkitektur av komplexet i kombination med FATZ-1 multivalenta ställningsfunktionen för att organisera interaktionspartners och stabilisera.
Sarcomere
De sammandragande musklerna kan reglera frivilliga djurrörelser och ofrivilliga hjärtslag, och sarkomerer är de grundläggande kontraktila enheterna hos strimmiga muskelceller. De består av matriser av tunna (aktin) och tjocka (myosin) trådar som glider förbi varandra under sammandragning. Z-skivan kan bilda gränsen mellan intilliggande sarkomerer, där antiparallella aktinfilament är förankrade. En lämpligt stabil förankringsstruktur måste genereras av interaktionen mellan myosin och aktin. Z-skivan kan fylla denna roll genom att fungera som ett mekaniskt nav och en signalplattform för att möjliggöra överföring av spänning under sammandragning och varaktighet och överföring av information om biomekanisk stress. Som ett resultat, alla mutationer som stör Z-diskens arkitektur och funktion kan riskera att orsaka skelett- och hjärtfunktion.
Proteinkomplexet
Alfa-aktinin är ett F-aktin-tvärbindande protein i muskel-Z-skivor, som bildar en viktig Z-skivkomponent som tvärbinder antiparallella aktinfilament från närliggande sarkomerer för att fungera som en bindningsplattform för flera Z-skivproteiner, inklusive FATZ-1. FATZ-proteinerna kan binda till α-actinin genom deras c-terminala region och till Enigma-familjemedlemmarnas domäner via ett specifikt c-terminal igenkänningsmotiv. I det här arbetet, Antonio Sponga et al. visat hur FATZ -proteiner innehöll egensyndriga regioner (IDR) som bäst beskrivs som en konformationell ensemble, som är mindre stabila och saknar en stabil tertiär struktur. Förutom biofysiska karakteriseringsmetoder, laget använde röntgenkristallografi och småvinklad röntgenspridning för att beskriva ett "flummigt" a-aktinin-2/FATZ-1-komplex. FATZ-1-proteinet kan spela en organisatorisk roll i Z-disken på grund av dess multivalenta ställningsegenskaper och bilda ett tätt komplex av polarkitektur med α-actinin-2.
FATZ-1 bildar ett tätt 2:1-komplex med a-aktinin-2-dimer via flera bindningsställen. (A) schema över a-aktinin-2-konstruktionerna, tillsammans med deras aminosyragränser och domänkomposition. SEC-MALS-analys för interaktionen mellan FATZ-1, FATZ-2, och FATZ-3 med a-aktinin-2 (B), N-FATZ-1 med stav-α-aktinin-2 (C), Δ91-FATZ-1 med hd-α-actinin-2 (D), och femE A91-FATZ-1-mutant med a-aktinin-2 (E). ITC-analys för interaktionen mellan Δ91-FATZ-1 och α-aktinin-2 (F), N-FATZ-1 med stav-α-aktinin-2 (G), Δ91-FATZ-1 med hd-α-actinin-2 (H), och femE A91-FATZ-1-mutant med a-aktinin-2 (I). n.d., inte bestämd. (J) 1H-15N HSQC signalintensitetsförhållande på 15N Δ91-FATZ-1 bunden/fri, kartläggning av primärt bindningsställe för FATZ-1 för a-aktinin-2. Ej tilldelad del i FATZ-1 är boxad, och rester plottas vid en slumpmässig position. (K) Sekvens av FATZ-1 som visar flera interaktionsställen för a-aktinin-2, bestämt från peptiduppsättningen (kvadrerade rester), XL-MS (stjärna), LP-MS (rester avgränsade med pilar), och NMR (pilar). Rester som matchar den starkaste signalpeptiden i peptiduppsättningen visas med fet stil. Gränser för Δ91-FATZ-1 och mini-FATZ-1 avgränsas av pilar. Mutationer inom femE Δ91-FATZ-1 och RRE 91-FATZ-1 indikeras med orange och mörk cyan, respektive. Upphovsman:Science Advances, doi:10.1126/sciadv.abg7653 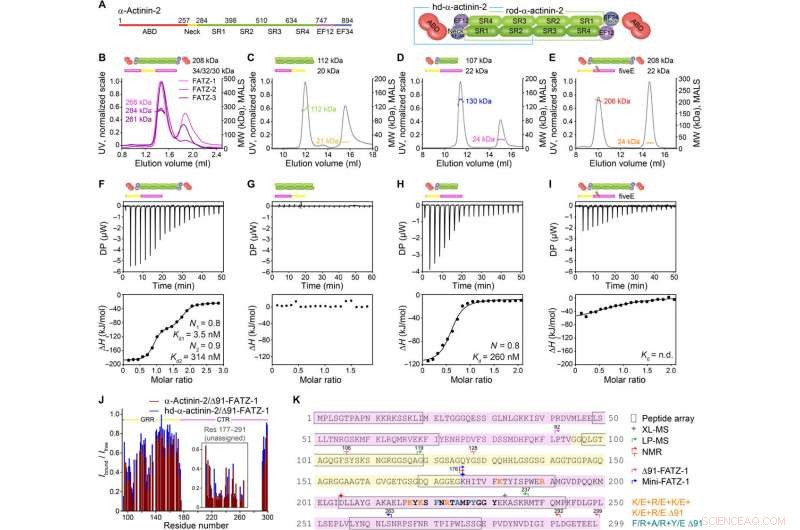
FATZ-proteinfamiljen finns över alla ryggradsdjur där humant FATZ-1, FATZ-2, och FATZ-3 delar 34 till 40 procent sekvensidentitet. Forskarna kände igen proteolysresistenta fragment, efter att ha genomfört proteolysförsök. När de kombinerade storleksekskluderingskromatografi (SEC) med ljusspridning med flera hörn, de noterade de dominerande monomererna under experimentella förhållanden. De karakteriserade sedan ytterligare monomererna med hjälp av SEC kombinerat med liten vinkelröntgenspridning och belyste också monomerernas inneboende störning/ensemble-tillstånds natur med användning av enkelkvant koherens (HSQC) spektra, för båda konstruktionerna. För att förstå bindningsstökiometri av FATZ-1-till-3-proteinerna till a-aktinin-2, Sponga et al. använt storleksekskluderingskromatografi-flersidig ljusspridning (SEC-MALS). För att karakterisera bindningsstökiometri av FATZ-1-till-3-proteinerna till a-aktinin-2, Sponga et al. används SEC-MALS. Resultatet visade hur vart och ett av de tre FATZ-proteinerna bildade ett tätt komplex med α-aktinin-2, med en bindande stökiometri av två FATZ-molekyler per a-aktinin-2-dimer. Det är en FATZ-molekyl per a-aktinin-2-subenhet. Teamet använde därefter isotermisk titreringskalorimetri (ITC) för att kvantifiera interaktionsaffiniteten.
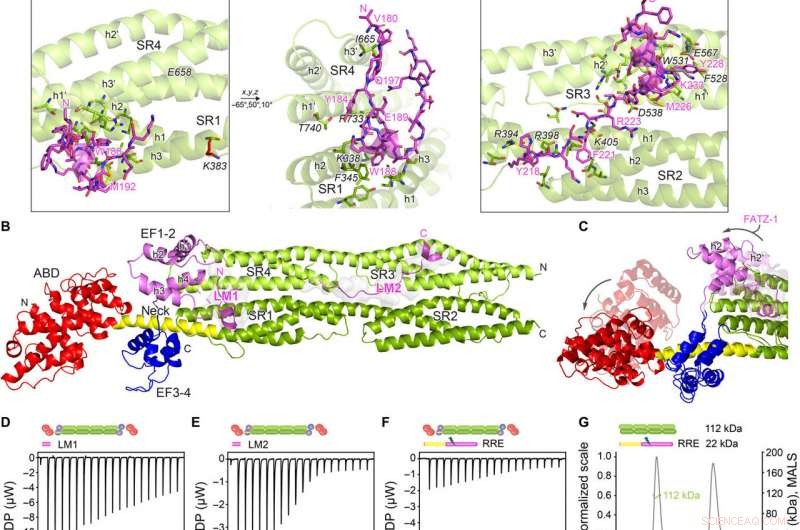
Kristallstrukturer av a-aktinin-2/FATZ-1 avslöjar två linjära bindningsmotiv i FATZ-1. (A) Kristallstruktur av stav-α-aktinin-2/mini-FATZ-1 (i grönt/magenta), tillsammans med den bestämda FATZ-1-konsensussekvensen (35 till 80% och 60 till 84% parvis sekvensidentitet för LM1 och LM2, respektive). Tvärbundna rester indikeras med blått, röd, och grå stjärnor/bollar/pinnar på sekvensen/strukturen. Identifierade Se-Mets visas i gult. Stav-α-aktinin-2-dimeren monteras genom en kristallografisk tvåfaldig axel mellan symmetrikompisar (svart cirkel). Interagerande rester (rod-α-actinin-2 i kursiv), tillsammans med spiraler från SR1/SR2 (h1, h2, och h3) och SR3/SR4 (h1 ′, h2 ′, och h3 ′), visas i närbilder. (B) Kristallstruktur för hd-α-actinin-2/91-FATZ-1 (LM1 och LM2 som magentatecknad och transparent grå yta; hd-α-actinin-2 färgkodad som i figur 2A). (C) Jämförelse av obunden [Protein Data Bank (PDB) kod 4D1E] och bunden (detta arbete) hd-α-actinin-2. ABD och EF1-2 för obundet hd-a-aktinin-2 visas med transparens. ITC-analys för interaktionen mellan LM1-peptid och a-aktinin-2 (D), LM2-peptid med a-aktinin-2 (E), och RRE A91-FATZ-1-mutant med a-aktinin-2 (F). SEC-MALS-analys för interaktionen mellan RRE Δ91-FATZ-1-mutant med stav-a-aktinin-2 (G) och Δ91-FATZ-1 med E. histolytica-stav-α-aktinin-2 (H). Upphovsman:Science Advances, doi:10.1126/sciadv.abg7653
Flera bindningsställen för proteinkomplexet
Teamet noterade hur FATZ-1 interagerade med α-actinin-2 via flera bindningsställen. För att begränsa FATZ-1-bindningsställena, Sponga et al. använde begränsad proteolys och kemisk tvärbindning i kombination med masspektrometri på proteinkomplexet. För att sedan hjälpa kristalliseringen av detta proteinkomplex, teamet kombinerade sedan också informationen från peptiduppsättningen och genererade en kortare konstruktion känd som mini-FATZ-1 för ytterligare studier om deras strukturbiologi. Forskarna validerade sedan de suddiga modellerna som utvecklats i arbetet med hjälp av beräknad och experimentellt härledd egenviskositet - en hydrodynamisk parameter för proteinkonformation. För att sedan förstå bidraget från α-actinin-2 för att lokalisera FATZ-proteiner på Z-skivan i sarkomeren, Sponga et al. transfekterade GFP-märkta FATZ-1- eller FATZ-2-proteiner till odödliga musmyoblaster eller neonatala råttkardiomyocyter. Både FATZ-1 och -2-proteiner riktade korrekt till Z-disken och samlokaliserades med α-actinin-2.
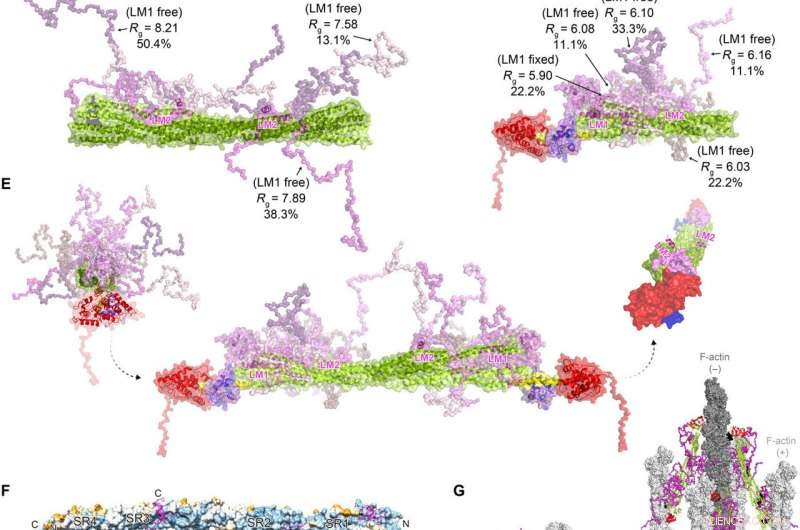
FATZ-1 bildar ett luddigt komplex med a-aktinin-2 vilket resulterar i en polär arkitektur av komplexet. Experimentella SAXS-data för stav-α-aktinin-2/91-FATZ-1 (A) och hd-α-aktinin-2/91-FATZ-1 (B), med motsvarande modell passar till data från de valda ensemblerna. GAJOE, Genetisk algoritmbedömning av optimering av ensembler. Flexibla områden i Δ91-FATZ-1, osynliga i våra bestämda kristallstrukturer, genererades med EOM som höll LM1 antingen fast eller ledigt (10, 000 modeller för varje). Utvalda ensemblemodellrepresentanter för rod-α-actinin-2/Δ91-FATZ-1 (C) och hd-α-actinin-2/Δ91-FATZ-1 (D), tillsammans med deras Rg och volymfraktioner inom ensemblen. (E) Integrativ modell av fuzzy α-actinin-2/Δ91-FATZ-1 byggd med röntgenkristallografi och SAXS-modeller av hd-α-actinin-2/Δ91-FATZ-1. Rotation för LM2-spiraler av bundna FATZ-1-molekyler med avseende på varandra, samt vridvridning i stången längs den längsgående a-aktinin-2-axeln, visas i höger insats (FATZ-1 flexibla delar utelämnas för tydlighetens skull). (F) Ytan på stav-a-aktinin-2/FATZ-1-strukturen som visar sekvensbevarandet av a-aktinin-interagerande rester för FATZ-1 (inriktning utförd med 1505 a-aktininer från ryggradsdjur). (G) Modell av F-aktin/α-aktinin-2/FATZ-1 (F-aktin i ljus och mörkgrå) baserad på en kryo-elektron-tomografi-struktur för Z-skivan och den integrerande modellen. Upphovsman:Science Advances, doi:10.1126/sciadv.abg7653
Syn
På det här sättet, Antonio Sponga och kollegor beskrev hur sarkomerenheten startade från Z-kroppar av α-actinin-2, att inkludera proteiner som FATZ, myotilin, och aktin, för att nämna några. Resultatet indikerar att proteiner från FATZ-familjen är tillgängliga i Z-kroppar och mogna Z-skivor med en roll i proteinsignaleringsvägar för att binda kalcineurin. Teamet belyste rollen som FATZ-1, den mest studerade familjemedlemmen och dess interaktion med det stora Z-skivproteinet α-actinin-2. Strukturen och bindningsmekanismen för det fuzzy α-actinin-2/FATZ-1-komplexet stöder FATZ-1-funktionen som ett klassiskt ställningsprotein i Z-diskaggregatet. Ytterligare studier kommer att avslöja om samma principer gäller under fysiologiska förhållanden i levande celler.
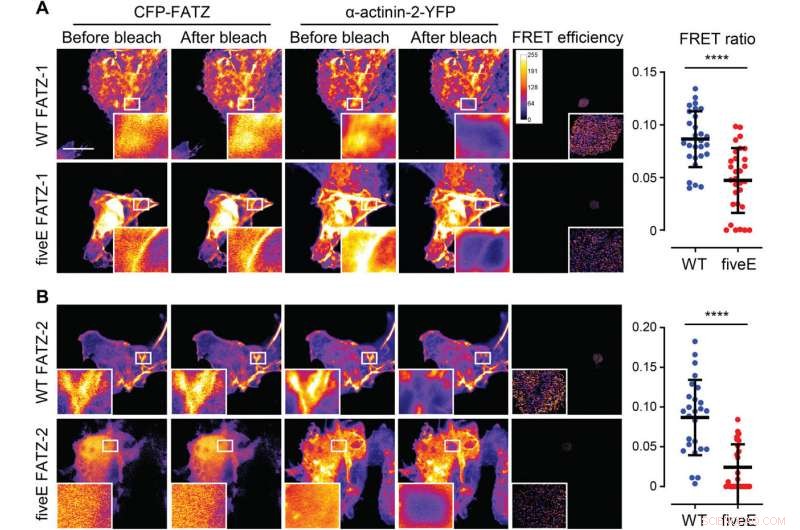
α-Actinin-2 stabiliserar FATZ-proteiner vid Z-skivan. (A) COS-1-celler som samtidigt uttrycker förbättrad CFP (ECFP) -märkt FATZ-1 (WT FATZ-1) eller motsvarande femE-mutant, i kombination med aktinin-2-EYFP, som bestämts i fixerade celler genom acceptorfotoblekning. Representativa bilder visas före och efter blekning för båda proteinerna. Blekade områden av intresse visas (inlägg), tillsammans med FRET -effektivitet som används för att beräkna FRET -förhållanden som presenteras i den intilliggande grafen [n =28 (WT) och 30 (fiveE), **** P <0,0005, Studentens test). (B) Samma celler som i (A) men samtidigt uttryckande av ECFP-märkta FATZ-2-varianter i kombination med EYFP-α-actinin-2 [n =26 (WT) och 25 (fiveE), **** P <0,0005, Studentens test). Skalstänger, 10 μm i alla bilder. Upphovsman:Science Advances, doi:10.1126/sciadv.abg7653
© 2021 Science X Network