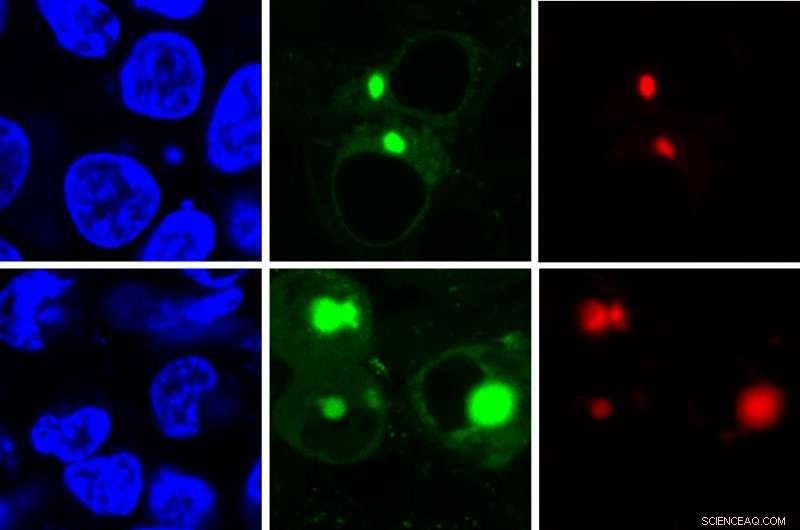
Den nya AggTag-metoden gör det möjligt för forskare att se de tidigare odetekterbara men potentiellt sjukdomsframkallande mellanformerna av proteiner när de viker sig fel. Metoden använder fluorescens för att samtidigt detektera två olika proteiner (röd, grön) i cellen (blå). Kredit:Zhang Lab, Penn State
En ny metod använder fluorescens för att upptäcka potentiellt sjukdomsframkallande former av proteiner när de lossnar på grund av stress eller mutationer. Ett team av forskare från Penn State och University of Washington omkonstruerade en fluorescerande förening och utvecklade en metod för att samtidigt lysa upp två olika proteiner när de vikas fel och aggregeras inuti en levande cell, belyser former som sannolikt spelar en roll i flera neurodegenerativa sjukdomar inklusive Alzheimers och Parkinsons. Två nya artiklar som beskriver metoden visas online i ChemBioChem och den Journal of the American Chemical Society .
"För att fungera korrekt, proteiner vikas till mycket exakta strukturer, men miljöstress eller patogena mutationer kan göra att proteiner felveckas och aggregerar, sa Xin Zhang, biträdande professor i kemi och i biokemi och molekylärbiologi vid Penn State och ledare för forskargruppen. "Proteinaggregation är en process i flera steg, och man tror att mellanformen, som tidigare bildtekniker inte kunde upptäcka, är ansvarig för ett antal sjukdomar, inklusive Alzheimers, Parkinsons, Diabetes typ 2, och cystisk fibros. Vi utvecklade Aggregation Tag-metoden – AggTag – för att se dessa tidigare odetekterbara mellanprodukter – lösliga oligomerer – såväl som de slutliga aggregaten i levande celler."
Tidigare tekniker för att identifiera proteinaggregation använde fluorescerande föreningar som alltid var upplysta, vilket gjorde det omöjligt att skilja ordentligt vikta proteiner från mellanformen eftersom båda utlöser diffus fluorescens på låg nivå. AggTag-metoden använder "tänd fluorescens, så blandningen tänds bara när felveckning börjar inträffa.
"När det fluorescerande ämnet har gott om utrymme att röra sig, den roterar fritt och förblir avstängd, som i närvaro av ett korrekt veckat protein, sa Yu Liu, biträdande forskningsprofessor i kemi vid Penn State och nyckelutvecklaren av AggTag-metoden. "Men när proteinet börjar felveckas och aggregeras, blandningens rörelse blir begränsad och den börjar lysa. Diffus fluorescens indikerar att mellanliggande oligomerer är närvarande, medan små punkter med ljusare fluorescens indikerar att de tätare olösliga aggregaten är närvarande."
För att möjliggöra denna distinktion mellan former, forskargruppen omkonstruerade den färgorsakande kärnan i det gröna fluorescerande proteinet (GFP), som vanligtvis används i bildstudier eftersom det fluorescerar när det utsätts för vissa våglängder av ljus. Den omarbetade föreningen binder till en tagg, som i sin tur smälter samman till ett protein som är avsett för bildbehandling.
Forskargruppen använde två olika typer av kommersiellt tillgängliga taggar, Halo-tagg och SNAP-tag, som när den används med AggTag kan inducera röd eller grön fluorescens, respektive. Eftersom Halo-taggar och SNAP-taggar inte interagerar med varandra, de kan användas för att samtidigt avbilda två olika proteiner med de två färgerna. Teamet konstruerade också taggarna så att de gröna och röda färgerna kan vändas, ge forskare alternativ för framtida bildbehandling.
"Vi planerar att fortsätta utveckla denna metod så att vi kan signalera övergången av oligomerer till olösliga aggregat med hjälp av en färgförändring, ", sa Zhang. "Denna metod ger en ny verktygslåda för att studera proteinaggregation, som för närvarande är ett mycket studerat ämne bland forskare. Förhoppningsvis kommer detta att tillåta oss att bättre förstå hela processen för proteinaggregation och rollen för var och en av dessa former i utvecklingen av neurodegenerativa och andra sjukdomar."