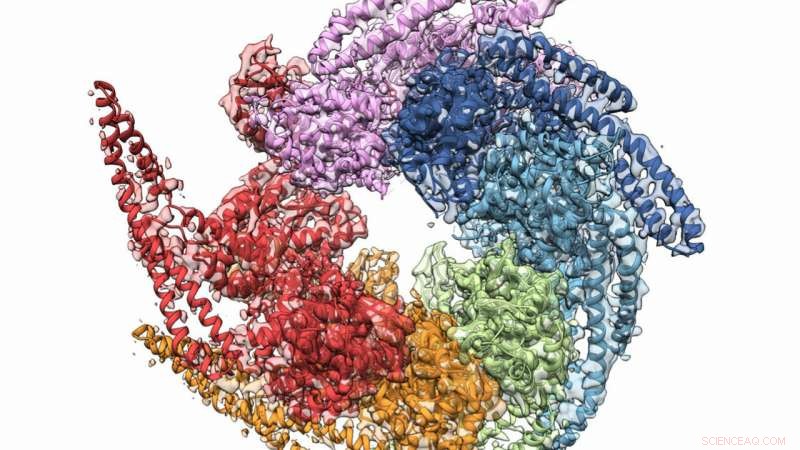
De kombinerade kristall- och kryo-elektronmikroskopstrukturerna i Hsp104 skiljer sig från svampen Calcarisporiella thermophila . Upphovsman:Grigore Pintilie / Stanford University
Röntgen- och elektronmikroskopitekniker hjälper till att utveckla historien om proteinchaperoner.
En kombination av röntgenkristallografi och kryo-elektronmikroskopi (cryo-EM) hjälpte till i ett samarbete för att få den högsta upplösta strukturen för svampproteinet Hsp104, som kan hindra bildandet av vissa degenerativa sjukdomar. Laget, vars medlemmar inkluderade forskare från US Department of Energy's (DOE) Argonne National Laboratory, verifierade också en spiralformad struktur för de proteinbildade hexamererna, trodde en gång platt. Resultaten publicerades online i december 27, 2018 nummer av Strukturera .
Hsp104 är ett hexameriskt AAA+ -protein som kallas en chaperone, vilket hjälper i de naturliga vikningsprocesserna av proteiner för korrekt cellfunktion. Mer viktigt, kanske, denna klass av hexamerer kan reparera felveckade eller aggregerade proteiner som kan leda till protein-orsakade abnormiteter som neurodegeneration.
Varianter av dessa chaperoner är vanliga bland flercelliga organismer, men Hsp104 har ingen homolog bland människor och andra djur. Även om det är mer robust än mänskliga härledare som kan misslyckas under cellulär stress, Hsp104 har observerats vikande humana proteiner.
"Vi gjorde några experiment där vi uttryckte humana proteiner i jäst, vilket gör jästen sjuk eftersom de aggregerar. Men om du uttrycker Hsp104, den från svampen Calcarisporiella thermophila , det skyddar jästen från denna aggregeringssjukdom, "sade Argonne Distinguished FellowAndrzej Joachimiak.
Joachimiak arbetade med ett team bestående av forskare från Argonne, University of Chicago, Stanford University och University of Pennsylvania för att få en bättre förståelse av Hsp104:s struktur och funktion.
Teamet vände sig till Argonnes Advanced Photon Source, en DOE Office of Science User Facility, att undersöka proteinets struktur med hjälp av röntgenkristallografi. De undersökte 30 olika prover, inklusive 14 Hsp104 chaperoner från olika källor. I denna process, en enda kristall störtades i flytande kväve och utsattes för hårda röntgenstrålar från vilka diffraktionsmönster samlades upp och strukturen rekonstruerades. Endast proteinet från Calcarisporiella svamp diffrakterad till hög upplösning, noterade Joachimiak.
För att bättre förstå proteinets strukturella förhållande inom en levande cell, de vände sig sedan till en undersökning av proteinet i lösning. Prover screenades med elektronmikroskopi vid University of Chicago och skickades sedan till Stanford University, där kryo-elektronmikroskop samlade de högupplösta molekylära data som krävs för att bestämma struktur genom komplex beräkning. Som med kristallutredningen, de Calcarisporiella provet gav den bästa upplösningen.
Nu beväpnad med den högsta upplösningen av Hsp104 i både kristallform och i lösning, laget kunde göra tidigare okända eller osäkra bestämningar om proteinets egenskaper och beteenden.
Innan teamets upptäckt, biologer trodde att Hsp104 stödde fem domäner, oberoende delar av proteinet som tjänar specifika funktioner. Men de nya high-fidelity-strukturerna avslöjade inte bara bara fyra domäner, men en tydligare bild av hur de förhåller sig till varandra.
N -terminaldomänen, till exempel, antas binda till ett felvikt protein och hjälpa det att utvecklas till en linjär form. Detta gör att den kan passera genom en smal central kanal i hexamer skapad av två AAA -domäner (ATPaser associerade med olika cellulära aktiviteter). Proteinet styrs, eller omplacerad, genom denna kanal till den andra sidan av hexamer, där den nu har en ny möjlighet att vika korrekt.
"Folk hävdade tidigare att en annan, C -terminaldomänen, var avgörande för bildandet av hexamer, men vi har visat att detta inte är sant, "sa Joachimiak.?" Det interagerar inte med andra underenheter, men kan fungera som ett dockningsområde för andra chaperoner för att hjälpa till att återbryta proteiner. "
En annan nyckelfynd hjälpte till att vända en långvarig tro på att Hsp104:s hexamerer var platta. Båda undersökningsmetoderna bevisade otvetydigt att de är spiralformade, hjälpa forskare att förstå hur chaperonen bildar kanalen? "reparation".
Teamet planerar att fortsätta utforska de många och varierade chaperoner som finns utanför det mänskliga genomet. De tror att dessa chaperoner kan fungera som en terapeutisk strategi med potential att bokstavligen avveckla proteiner som kan leda till allvarlig sjukdom.
"Det är möjligt att det finns andra chaperones där ute som är bättre än våra, och att de kommer att kunna behandla proteiner som samlas i hjärnan och orsakar sjukdomar, "sa Joachimiak.?" Det skulle verkligen vara fantastiskt. "
Pappret, "Strukturen av Calcarisporiella thermophila Hsp104 dissegregas som motverkar olika proteotoxiska felfällningar, "visas i tidningen 27 december online Strukturera . Förutom Joachimiak, Argonne -forskaren Karolina Michalska bidrog till denna studie.