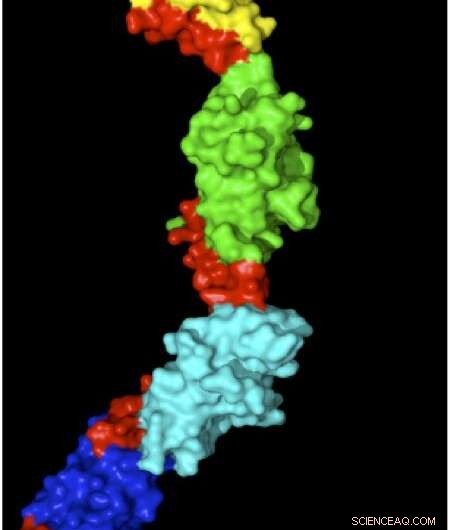
Strukturen av myomesin med elastiska områden som visas i rött. Kredit:Matthias Wilmanns
Proteiner som tillverkas i våra celler viks till specifika former så att de kan fylla sina funktioner. Forskare har upptäckt de statiska strukturerna hos över 100, 000 proteiner, men hur de förändras som svar på krafter på cellen, som muskelsammandragningar, är i stort sett okänd. Matthias Wilmanns och kollegor vid European Molecular Biology Laboratory i Hamburg, Tyskland, utvecklat metoder för att studera strukturen hos en protein "strain absorber" då den förändras under muskelsammandragningar. De kommer att presentera sitt arbete på Biophysical Societys 63:e årsmöte, hålls 2—6 mars, 2019 i Baltimore, Maryland.
Varje muskelenhet har en serie välorganiserade proteinstavar som dras för att överlappa varandra när en muskel dras samman eller dras isär när en muskel sträcks. Myomesin är ett protein som stabiliserar och organiserar dessa stavar, agerar för att absorbera belastningen på sträckta muskler för att förhindra att muskelenheterna går sönder. Wilmanns, i samarbete med Matthias Riefs grupp vid Münchens tekniska universitet, använde atomkraftsmikroskopi för att sträcka och mäta enskilda myomesinmolekyler. Myomesin blev 2,5 gånger längre under våld, och deras högupplösta struktur visade att detta berodde på slinky-liknande länkar i proteinet som tillåter det att sträcka sig utan att vecklas ut. Dock, en nyckelfråga kvarstår om att visa att dessa mekanismer även gäller under fysiologiska förhållanden. För att ta itu med denna fråga, Wilmanns och kollegor designar nu experiment för att visualisera förändringarna i myomesin inuti muskelceller med hjälp av superhögupplöst bildbehandling.
"Muskel är en bra modell för att titta på hur dess proteiner svarar på kraft, eftersom den upplever extraordinärt höga krafter, men vi har små krafter över hela kroppen, ", förklarade Wilmanns. "Nu har vi metoder som är tillräckligt känsliga för att mäta mycket små krafter, så vi kan börja titta på beteendet hos olika proteiner som svarar på mycket små krafter. För närvarande är det så lite känt om mekanismer för molekylär elasticitet i proteiner."