Kredit:Wiley
Antibiotikaresistenta bakterier är ett ökande hälsohot, gör ny antibiotika nödvändig. Tyska forskare har nyligen fått ett genombrott:de upptäckte lugdunin i människans näsa - en ny sorts cyklisk peptid som kommer från bakterien Staphylococcus lugdunensis och har starka antimikrobiella egenskaper mot Stahphylococcus aureus, bland andra. Forskarna har kunnat klargöra verkningssättet genom att syntetisera varianter. Som de förklarar i journalen Angewandte Chemie , protontransport över bakteriemembran är inblandad.
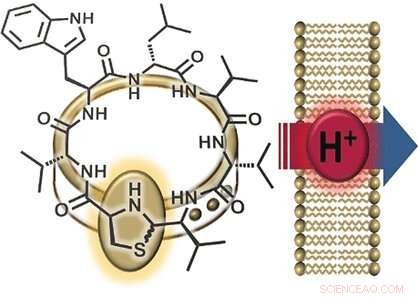
En intressant del av lugdunins struktur är dess tiazolidingrupp (en ring gjord av ett kväve, ett svavel, och tre kolatomer), som utgör en del av dess peptidring. Denna femledade ring liknar ett spänne som "pryder" peptidringen. Av denna anledning, forskarna döpte sin nya klass av material till "fibupeptider, " från latin vadben , menande lås . Efter att tidigare ha lyckats syntetisera lugdunin, teamet från universitetet i Tübingen och universitetet i Göttingen (Tyskland) optimerade den syntetiska vägen för att göra många olika derivat av detta naturliga ämne. Detta möjliggjorde en omfattande studie av mekanismen med vilken lugdunin fungerar. Forskarna gjorde en serie derivat där de ersatte var och en av aminosyrorna i peptidringen med alanin - en där de lämnade "prydnadsspännet, " och en fibupeptid med en struktur som är spegelbilden av lugdunin. De använde sedan dessa derivat för att utföra aktivitetstester.
Laget, bestående av kemister, biokemister, och mikrobiologer, upptäckte att peptidens cykliska struktur, tiazolidinlåset, "och två aminosyror (tryptofan och leucin), är kritiska för föreningens antibiotikaaktivitet. Dessutom, peptidringen måste alltid vara gjord av alternerande D- och L-aminosyror. Dock, det fanns ingen skillnad i aktiviteten hos den ursprungliga molekylen eller dess spegelbild. "Detta indikerar en brist på stereospecifik receptor-ligandinteraktion, säger Nadine Schilling, en medlem av teamet som leds av Stephanie Grond, "istället, det talar för interaktion med en liten molekyl eller jon."
En ytterligare observation var att aktiva lugduninderivat bryter ner den elektriska potentialen (skillnaden i spänning mellan det inre och yttre) hos bakteriecellsmembran, därigenom dödar bakterierna. Att införliva ytterligare en tryptofanmolekyl intensifierade interaktionen med membranet och stärkte den antibakteriella effekten. Säger Grond:"Dessa resultat tyder på jontransport över bakteriemembranet." För att närmare undersöka denna funktion, forskarna producerade syntetiska vesiklar med en pH-gradient i förhållande till den omgivande lösningen. Tillsats av aktiva fibupeptider ledde till snabb pH-utjämning, utan förstörelse av membranet eller bildande av porer. "Mekanismen består helt klart av translokation av protoner över membranet, " säger Grond. "Vi behöver fortfarande avgöra om lugdunin fungerar som en mobil transportör eller en protonkanal."