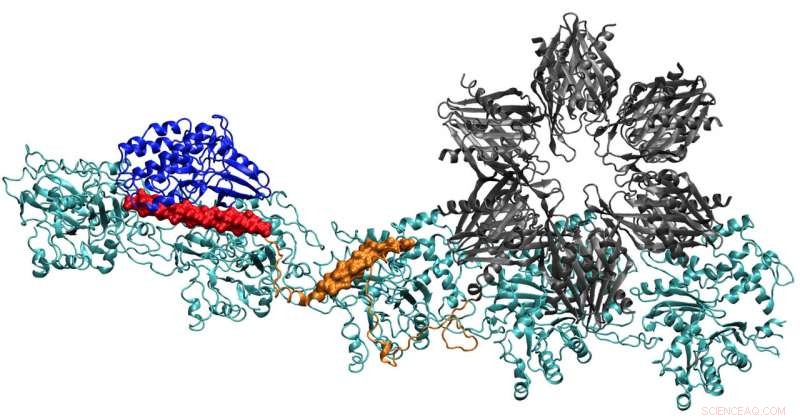
En modell av CaMKII-proteinet visar flera domäner som gör att det kan binda aktinfilament i neuronernas dendriter till buntar, ger dendriterna sin form. Forskare vid Rice University, University of Houston och University of Texas Health Science Center i Houston tror att komplexet är nyckeln till bildandet av långtidsminne. Kredit:Wolynes Research Lab/Rice University
En ny bit i ett svårt pussel – minnets natur – föll på plats den här veckan med en hint om hur hjärnceller ändrar struktur när de lär sig något.
Interaktioner mellan tre rörliga delar - ett bindande protein, ett strukturellt protein och kalcium – är en del av den process genom vilken elektriska signaler kommer in i neurala celler och omformar de molekylära strukturer som tros möjliggöra kognition och lagring av minnen.
Kollegor från Rice University, University of Houston (UH) och University of Texas Health Science Center i Houston (UTHealth) kombinerade teorier, simuleringar och experiment för att bestämma hur ett centralt bindande protein - kalcium-kalmodulinberoende kinas II (CaMKII) - binder och avbinder från en neurons cytoskelett.
Lagets rapport i Proceedings of the National Academy of Sciences ger de första tydliga detaljerna om hur bindningsställena för CaMKII fungerar för att anpassa aktinfilament - det strukturella proteinet - till långa, stela buntar. Knivarna fungerar som stödskelett av dendritiska ryggar, taggiga utsprång som tar emot kemiska meddelanden genom synapser från andra neuroner.
Peter Wolynes, en teoretisk fysiker vid Rice, gick med i ett pågående samarbete av UH-fysikern Margaret Cheung och UTHealths neurobiolog Neal Waxham som syftade till att förstå hur signaler tar sig igenom dendriter, grenarna på nervceller som överför information mellan celler.
Att hitta den fullständiga strukturen av CaMKII har visat sig vara för komplex för röntgenkristallografi, även om delar av dess struktur var kända. När det kombineras med aktinet som utgör cytoskelettet, systemet blev också det största proteinet som Wolynes och hans team har analyserat via sitt program för förutsägelse av proteinstruktur, AWSEM.
När de var klara, strukturen som förutspåddes av datorn var en anmärkningsvärd matchning för tvådimensionella elektronmikroskopbilder av Waxham och hans grupp som tydligt visar att parallella aktinfilament hålls samman, stegliknande, av stegpinnar av CaMKII.
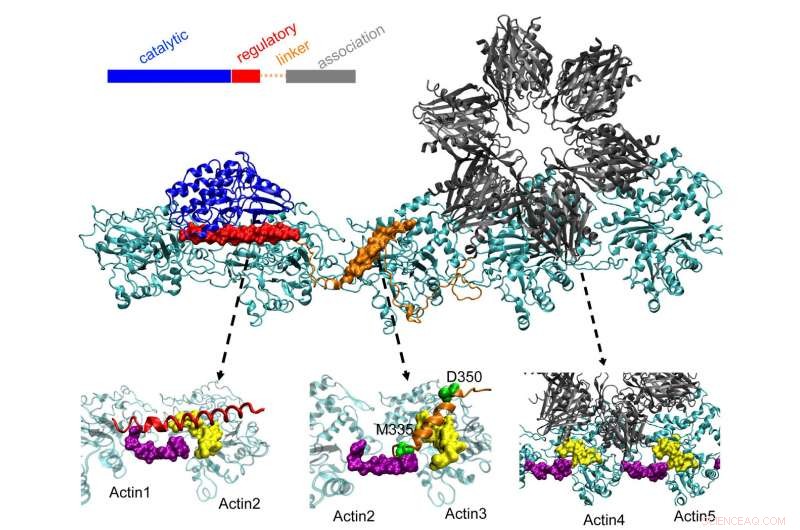
CaMKII-proteinet på toppen dockar i tre fickor på vridna aktinfilament i neuroner, en process som forskare vid Rice University, University of Houston och University of Texas Health Science Center i Houston (UTHealth) tror är viktigt för att bilda långtidsminne. Den regulatoriska domänen (röd) på CaMKII binder också till inkommande kalmodulinproteiner, som packar upp hela strukturen från aktin och låter buntade filament omorganiseras. Kredit:Wolynes Research Lab/Rice University
"Det finns definitivt preliminära kemiska steg som involverar enzymaktiviteten hos CaMKII innan du kommer till detta stadium; därför, vi har inte en helt klar bild av hur man sätter ihop allt, " Sa Wolynes. "Men det är uppenbart att sammansättningen av komplexet är nyckelsteget där kemi förvandlas till en större struktur som kan hålla ett minne."
CaMKII är unikt lämpad för att interagera med aktin, det vanligaste proteinet i eukaryota celler och ett som har speciella förmågor i neuroner, där den inte bara måste ge tusentals dendriter (i var och en av miljarder neuroner) deras vilande former utan också måste ge dem en nivå av plasticitet för att anpassa sig till en konstant störtflod av signaler.
Aktinmolekyler sätts samman till långa, vridande filament. De hydrofoba fickorna mellan dessa molekyler är perfekt konfigurerade för att binda CaMKII, ett stort protein med flera delar, eller domäner. Dessa domäner låser sig till tre på varandra följande bindningsställen på filamentet, och vändningarna sätter bindningsställen med jämna mellanrum för att förhindra att proteinerna hopar sig.
CaMKIIs "associations"-domän är en sexfaldig subenhet som också binder till intilliggande filament för att bilda aktinknippen, ryggraden i dendritiska ryggraden som ger dessa utsprång deras former.
Dessa buntar förblir stela om dendriten innehåller lite kalcium. Men när kalciumjoner kommer in genom synapsen, de kombineras med kalmodulinproteiner, låter dem binda till en annan del av CaMKII, den floppy regulatoriska domänen. Det utlöser bortkopplingen av en domän av CaMKII från glödtråden, följt av resten av proteinet, öppnar ett kort tidsfönster under vilket paketen kan konfigureras om.
"När tillräckligt med kalcium kommer in, det aktiverade kalmodulinet bryter upp dessa strukturer, men bara för en stund, " sa Wolynes. "Då reformeras cytoskelettet. Under tiden, dendritiska ryggraden kan anta en annan form som kan vara större."
"Vi vet att kalcium för in information in i cellen, " Cheung tillade. "Men hur nervceller vet vad de ska göra med det beror verkligen på hur detta protein kodar information. En del av vårt arbete är att koppla ihop det på molekylär nivå och sedan projicera hur dessa enkla geometriska regler utvecklar strukturer i större mikroskala."

En elektronmikroskopbild visar aktinfilament som hålls samman i parallella eller förgrenade arrangemang av CaMKII-proteiner i en neuron. Simuleringar och experiment utförda vid Rice University, University of Houston och University of Texas Health Science Center i Houston visade att avståndet mellan intilliggande CaMKII-partiklar i komplexen är nästan fixerat till 36 nanometer. Skalstången är 100 nanometer. Bilden gjordes i Structural Biology Imaging Center vid McGovern Medical School vid UTHealth. Kredit:Waxham Lab/UTHealth
Teamets beräkningar visade att associationsdomänen är ansvarig för cirka 40 % av proteinets bindningsstyrka till aktin. En länkdomän lägger till ytterligare 40 % och den avgörande regulatoriska domänen ger de sista 20 % - en vettig strategi, eftersom den regulatoriska domänen är på jakt efter inkommande kalcium-calmoduliner som kan packa upp hela proteinet från filamentet.
Projektet kom samman genom Rice's Center for Theoretical Biological Physics (CTBP), där Wolynes är meddirektör och Cheung en senior vetenskapsman. Deras förening går tillbaka till när båda var vid University of California, San Diego, han som professor och hon som doktorand hos risfysikern José Onuchic, också en CTBP meddirektör. Wolynes var också med i hennes granskningspanel för avhandling, Hon sa.
Cheung var medveten om tidigare arbete av Wolynes och hans Rice-grupp som föreslog att aktin stabiliserar prionliknande fibrer som tros koda minnen i neuroner och beslutade att det var en bra match för hennes forskning med Waxham för att se hur kalcium aktiverar CaMKII.
"Detta är ett av de mest intressanta problemen inom neurovetenskap:Hur leder kortsiktiga kemiska förändringar till något långsiktigt, som minne?" sa Waxham. "Jag tror att ett av de mest intressanta bidragen vi gör är att fånga hur systemet tar förändringar som sker på millisekunder till sekunder och bygger något som kan överleva den initiala signalen."
Pusslet är långt ifrån komplett, sa Wolynes. "Det tidigare arbetet av Margaret och Neal handlade om initieringen av minneshändelser, " sa han om sina kollegors studie av kalmodulin. "Vårt prionpapper handlade om att bevara minnet, i slutet av inlärningsprocessen. Och aktin är i mitten. Det kan finnas många andra saker i mitten, för.
"De här stora frågorna är intressanta för många människor, ", sa han. "Detta är en viktig del av problemet, men det är helt klart inte slutet på historien."