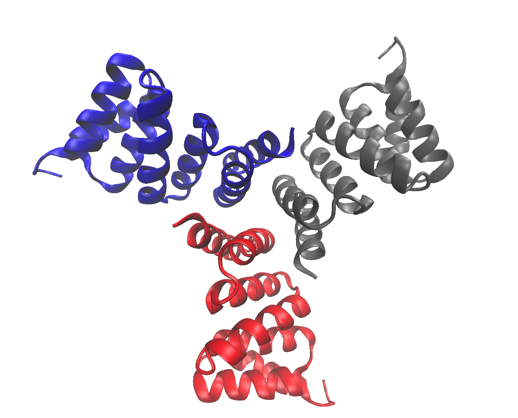
Den högupplösta kristallstrukturen för ett av de studerade proteinerna, en beräkningsmässigt utformad trimer. Strukturen har deponerats i Proteindatabanken med anslutningsnummer 5HRZ. Kredit:Lawrence Berkeley National Laboratory
Cykliska proteiner som sätts samman från flera identiska subenheter (homo-oligomerer) spelar nyckelroller i många biologiska processer, inklusive cellsignalering och enzymatisk katalys och proteinfunktion. Forskare vid Berkeley Labs avdelning för Molecular Biophysics and Integrated Bioimaging (MBIB) arbetade med David Baker vid University of Washington, som ledde ett team för att designa i silico och kristallisera självmonterande cykliska homo-oligomerproteiner.
Genom att förutsäga och designa dessa oligomerer av högre ordning, Baker och hans team har fått en förståelse för de grundläggande principerna bakom oligomer-oligomer-interaktioner. Utöver de interna interaktionerna av själva proteinet, dessa designade oligomerer kan användas för att utforska grundläggande frågor om hur strukturen hos signalmolekyler påverkar beteendet hos receptorer och cellulärt svar.
En strategi utvecklades för att designa gränssnitt till idealiserade proteiner som syftar till att styra deras sammansättning till multimera komplex. Berkeley Lab-forskare använde strukturell karakterisering - både röntgenkristallografi och liten vinkelröntgenspridning (SAXS) - för att visa att många av designerna antog måloligomeriseringstillståndet och förutspådd struktur. Deras arbete visar inte bara att forskare har en grundläggande förståelse för vad som bestämmer oligomerisering, det visar också att de kan designa proteiner med avstämbar form, storlek, och symmetri för en mängd olika biologiska tillämpningar.
En del av röntgenkristallografiarbetet som ingår i uppsatsen utfördes under ledning av Crystallography Collective-programmet, som drivs av forskaren Banumathi Sankaran vid Advanced Light Source. Forskarkollegan Henrique Pereira kristalliserade proteinerna designade av forskare från University of Washington. Sankaran och Peter Zwart, MBIB stabsforskare, samlade in kristallografisk data om Beamline 5.0.2 i Berkeley Center for Structural Biology och löste strukturerna. För att få information om den designade proteindynamiken, Kathryn Burnett och Greg Hura från MBIB utförde SAXS på SIBYLS beamline.
Pereira, Sankaran, och Zwart har varit medförfattare på flera tidningar med Baker och hans team, som alla följer ett tema av proteindesign och strukturvalidering.
"Cykliska homo-oligomerer spelar viktiga roller i biologisk funktion, ", sa Sankaran. "Här har vi en annan syntetisk design som har visat sig matcha beräkningsdesignen med både små vinkellösningar och röntgenspridning."
Detta jobb, tillsammans med de böjda beta-arket och trimeriska metalloproteindesignerna, vidga möjligheterna att utveckla nya terapier och biomaterial.