
Dr. Ohkanda håller föreningen strategiskt utformad för att haka in i enzymets hål. Kredit:Junko Ohkanda Ph.D., Professor i akademisk församling, Lantbruksinstitutet, Shinshu universitet
"Strategin var att designa läkemedlet för att kunna haka in i hålet på FTase och GGTase I, annars är ytan på proteinerna för stor och hala, " Dr. Junko Ohkanda från Shinshu University förklarar sin strategi bakom hennes uppsats som valts av Kemi—A European Journal som ett "Hot Paper".
Läkemedelsföretag runt om i världen har under de senaste 20 till 30 åren försökt att koka ihop ett effektivt läkemedel för att rikta in sig på K-Ras-proteiner. När K-Ras-proteiner muterar, de gör att multipelomkopplaren förblir ständigt på, blir en aggressiv och obehandlad form av cancer. I 90 till 100 % av de svåra lung- och bukspottkörtelcancer, K-Ras sägs spela en roll. 30 % av alla cancerformer sägs ha någon form av Ras-mutation.
Forskare har haft problem med att designa ett läkemedel för att infiltrera K-Ras på grund av bristen på interaktiva fickor. En ny strategi utarbetades för att attackera FTase, ett viktigt enzym i lipidmodifieringen av K-Ras. Utan FTase, det muterade K-Ras skulle inte kunna föröka sig okontrollerat. Forskare har utvecklat ett stort antal FTase-hämmare, men fann det svårt att inaktivera K-Ras modifiering.
Även när FTaset hämmades, K-Ras-modifieringar stoppades inte eftersom GGTase I också reagerade med K-Ras, trots dess olika reaktiva kavitet. Man förstod inte varför, tills dess mekanism klargjordes att FTas och GGTas I båda är gjorda av två proteindelar, varav en är densamma, med exakt samma DNA.
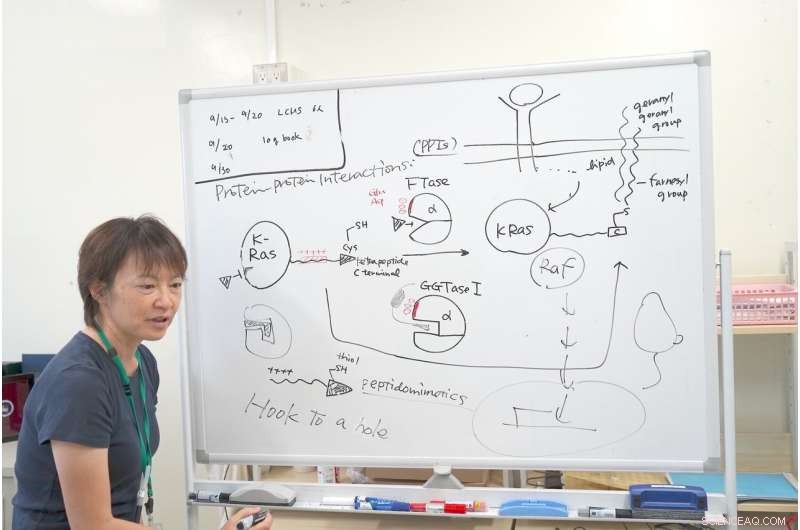
Dr Ohkanda förklarar mekanismen för hennes forskning med K-Ras. Kredit:Junko Ohkanda Ph.D., Professor i akademisk församling, Lantbruksinstitutet, Shinshu universitet
Nära den aktiverade kaviteten FTase och GGTase har jag samma kluster av sura aminosyror, som glutaminsyra och asparaginsyra, bär en negativ laddning. När man noggrant observerar K-Ras C-terminal, den hade en interaktiv positiv laddning. Andra Ras-proteiner har inte detta positivt laddade område. Endast K-Ras har detta kluster av positiva laddningar. Det är därför även om FTaset hämmades, K-Ras reagerade fortfarande med GGTase I, även om dess hålighet var annorlunda.
Det var här Dr Ohkanda hade sitt ögonblick av inspiration. I teorin, enzymets ficka och cystinnyckeln fäster och förenas. Men i det här fallet proteinernas ytor, med plus och minus samverkar också. Även om FTase hämmas interagerade K-Ras av misstag med GGTase I. Dr. Ohkanda och hennes kollegor trodde med en förening att de kunde ha två funktioner.
Strategin var att designa en molekyl för att efterlikna den del av K-Ras som verkar på den aktiva fickan och även den sura ytan. Det säger sig självt att läkemedlets funktion måste ske inuti cellen. Stora molekyler som är användbara i protein-protein-interaktioner är ofta för stora för att gå in i cellen. Detta är ett problem som många läkemedelsutvecklare förvirrar:leveransmetoder.
Dr Ohkanda tänkte om hon rationellt kunde designa tiolen på änden av K-Ras för att haka på den aktiva fickan av FTase och GGTase I, den utökade interaktiva positiva laddningsdelen kan interagera och penetrera cellmembranet. Om cysteindelen kunde haka fast i kaviteten, den anslutna interaktiva positiva kedjan kan vara liten och levereras strategiskt till enzymernas sura yta. Det var svårt att minimera föreningens storlek samtidigt som den ökade dess stabilitet och bibehöll dess förmåga till kemiska reaktioner. Genom att använda en peptidomimetik av samma längd och samma nyckel, de kunde framgångsrikt penetrera cellen in vitro, stör den skenande K-Ras multiplikationen.
Fler studier behövs för att öka föreningens aktivitet, testa in vivo och för att utvärdera dess toxicitet långt innan föreningen kan användas som behandling för cancer. Dr. Ohkanda fortsätter att arbeta med ett internationellt team av experter för att klargöra verkningsmekanismen och deras interaktioner för att rationellt utforma effektiva läkemedel för att stoppa förökningen av sådana celler.