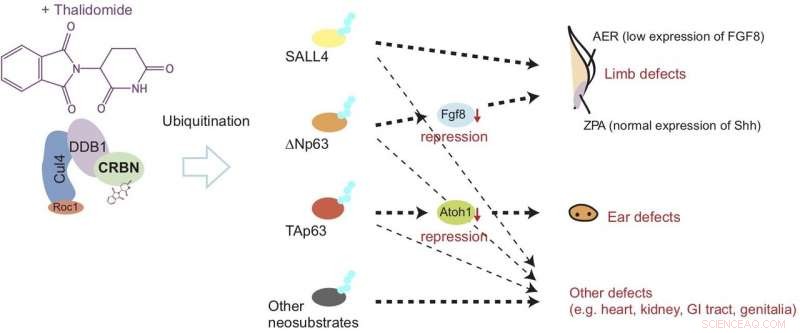
Talidomid binder till cereblon (CRBN) och orsakar onormal lem- och öronutveckling genom att inducera nedbrytning av proteiner som kallas? Np63α och TAp63α genom en process som kallas ubiquitination. Denna modell tyder på att defekterna utlöses genom nedreglering av tillväxtfaktorer som kallas Fgf8 och Atoh1. Kreditera: Natur kemisk biologi
Forskare i Japan och Italien har fördjupat förståelsen för hur talidomid orsakar utvecklingsavvikelser på molekylär nivå. En internationell studie medförfattare av forskare vid Tokyo Institute of Technology (Tokyo Tech) och Tokyo Medical University har presenterat en detaljerad bild av hur talidomid, ett av de mest ökända läkemedel som någonsin utvecklats, orsakar abnormiteter i lem- och öronutveckling. Fynden kan bidra till att säkra, eller icke-teratogen, talidomid-härledda läkemedel som behandling för cancer och inflammatoriska sjukdomar.
Ursprungligen använd i slutet av 1950 -talet som behandling mot morgonsjuka, bevis i början av 1960 -talet kopplade talidomid till avvikelser inklusive förkortade lemmar och defekta organ, vilket ledde till dess förbud runt om i världen. Anmärkningsvärt, baserat på efterföljande fynd som belyste talidomids antiinflammatoriska och andra fördelaktiga egenskaper, läkemedlet har blivit ett viktigt exempel på ett som kan återanvändas för att behandla tillstånd som spetälska och multipelt myelom, en typ av blodcancer.
"Talidomid-tragedin är inte ett öppet-och-stängt fall i medicinsk historia, men pågår, eftersom nya talidomidbarn har fötts efter det att de godkändes igen cirka 2000, "förklarar biokemisten Yuki Yamaguchi från Tokyo Tech." Men vi vet nu att talidomid och dess derivat är mycket effektiva och är förknippade med få biverkningar, förutom de teratogena effekterna på fostret, till skillnad från många andra konventionella anticancermedel. Därför, teratogenicitet är fortfarande ett stort hinder för bredare tillämpning av dessa lovande läkemedel. "
För att undersöka mekanismerna bakom talidomidaktivitet mer i detalj, Yamaguchi samarbetade med Hiroshi Handa från Tokyo Medical University, Luisa Guerrini från Universita degli Studi di Milano, Italien, och andra för att genomföra utvecklingsstudier med zebrafisk som modellorganism. Detta samarbete syftade till att utforska Guerrinis föreställning att proteinerna p63 kan vara kritiskt involverade. År 2010, ett team som leds av Handa och Yamaguchi uppnådde ett genombrott genom att identifiera cereblon som ett viktigt protein genom vilket talidomid initierar dess negativa eller teratogena effekter.
Nu, den senaste studien publicerad i Natur kemisk biologi visar att efter bindning till cereblon, talidomid orsakar skada på fenor (motsvarande lemmar) och öronblåsor (motsvarande öron) genom att inducera nedbrytning av två typer av p63 -protein. Specifikt, studien tyder på att nedbrytningen av ΔNp63α resulterar i lemfel, medan TAp63α leder till hörselskador, som visas i figur 1.
Att förstå hur cereblon fungerar för att förmedla effekterna av talidomid kan förändra hur läkemedel utvecklas - gå bort från serendipitös upptäckt och mot rationell molekylär design. "Förändringen skulle vara som ett skifte från att leta efter en nål i en höstack till att rista en nål ur benet, "Noterar Yamaguchi.
"Det är troligt att vi kommer att se utvecklingen av nya talidomidbaserade läkemedel utan teratogena effekter inom en snar framtid, " han säger.