Segmenten i CysLT1 -receptorn som är ansvariga för dess aktivering visas i orange, bredvid andra G-proteinkopplade receptorer. Upphovsman:Luginina et al./Science Advances
Ett forskargrupp från MIPT Center for Molecular Mechanisms of Aging and Age-Related Diseases har samarbetat med kollegor från USA, Kanada, Frankrike, och Tyskland för att bestämma den rumsliga strukturen för CysLT1 -receptorn. Tidningen publicerades i Vetenskapliga framsteg .
G-proteinkopplade receptorer, eller GPCR, är molekylära maskiner inkorporerade i cellmembran. Dessa receptorer tar upp specifika signaler på utsidan av en cell och överför dem till cellen. Signalerna kommer från olika källor, inklusive fotoner av ljus, fettmolekyler, små proteiner, och DNA -fragment. En GPCR kan utlösa olika händelser i cellen, som division, flytt, eller till och med döden.
Den GPCR-medierade cellulära "kommunikationen" är avgörande för en organisms funktion. Inte konstigt att dessa receptorer på något sätt är involverade i alla processer i våra kroppar. De är målen för cirka 40% av befintliga mediciner, för. Således, det är intressant för strukturbiologer att förstå hur dessa biologiska maskiner fungerar och hitta ett sätt att påverka dem, genom att utveckla nya läkemedel som har mer specificitet och färre biverkningar.
Strukturell biologi är ett tvärvetenskapligt område i gränssnittet mellan fysik och biologi, bekymrad över att studera 3D-arrangemanget av biologiska makromolekyler, såsom proteiner. Strukturstudier involverar genteknik, konstgjord proteinproduktion, rening, och kristallisation. När proteinkristallen har erhållits, fysiken kommer in:Forskare utsätter proteinkristallen för kraftfulla röntgenstrålar för att generera diffraktionsmönster. De resulterande uppgifterna kan matematiskt bearbetas för att återställa en detaljerad 3-D atomstruktur för en given proteinmolekyl, med en precision på upp till flera ångström.
Strukturstudier bygger på kraftfulla röntgenkällor. Dessa finns vanligtvis i två typer:synkrotroner och de nyare utvecklade fria elektronlasrarna. I båda fallen, elektroner accelereras till nästan ljusets hastighet. De tvingas sedan ändra sin hastighet eller rörelseriktning, som leder till röntgenemission. I en synkrotron, elektronerna rör sig längs en krökt, nästan cirkulär bana. I en fri elektronlaser, de färdas genom en passage mellan två rader med alternerande motsatt riktade magneter, känd som en böljare.
Medan strukturbiologer har använt synkrotroner sedan 1970 -talet, fria elektronlasrar är ett relativt nyligen tillskott till proteinkristallografiverktygssatsen. Introducerades i början av 2010 -talet, de genererar extremt kraftig strålning och möjliggör röntgendiffraktionsanalys av små 1 mikrometer kristaller. Detta nya instrument har redan medfört upptäckten av flera hundra strukturer.
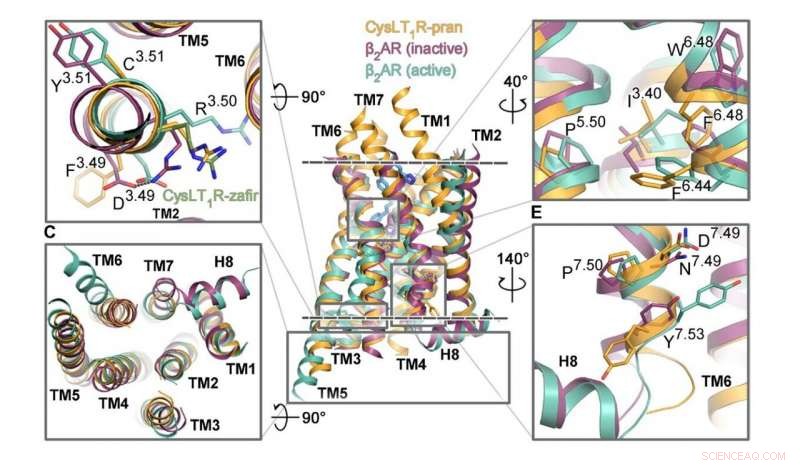
Forskare från MIPT har undersökt strukturen hos en GPCR som kallas CysLT1. Det är involverat i inflammatoriska processer och spelar en viktig roll vid allergiska sjukdomar, inklusive astma, vilket påverkar cirka 10% av världens befolkning. Teamet av biofysiker erhöll den detaljerade 3-D-strukturen för receptorn med molekylerna zafirlukast och pranlukast. Detta är två läkemedel som förskrivs till patienter med astma, allergisk rinit, och urtikaria.
Även om det är relativt stort, 0,3 millimeter kristaller med pranlukast odlades i studien, kristallerna med zafirlukast nådde bara storleken på flera mikrometer. De tidigare proverna undersöktes vid ESRF -synkrotronen i Grenoble, Frankrike. De senare undersöktes med hjälp av den Stanford University-drivna Linac Coherent Light Source, en fri elektronlaser. Forskarnas kollegor från Kanada hjälpte till att utforska mekanismerna för signalöverföring via CysLT1.
"Detta är utan tvekan unika strukturer, och vi har blivit ganska förtjusta i dem, "säger studieförfattaren Aleksandra Luginina från MIPT Laboratory of Structural Biology of G Protein-Coupled Receptors." CysLT1-receptorns driftsmekanism uppdaterar hur vi ser hur GPCR-proteinundergrupper fungerar. Också, genom att identifiera bindningsställena för zafirlukast- och pranlukastmolekylerna, Vi lägger grunden för att förbättra astmaläkemedel - öka deras effektivitet och minska biverkningar. "
GPCR är notoriskt svåra objekt för strukturstudier. Endast en handfull laboratorier världen över har lyckats slutföra forskningsprojekt av detta slag. MIPT -teamet är glada att ett institutlaboratorium nu finns bland dem.