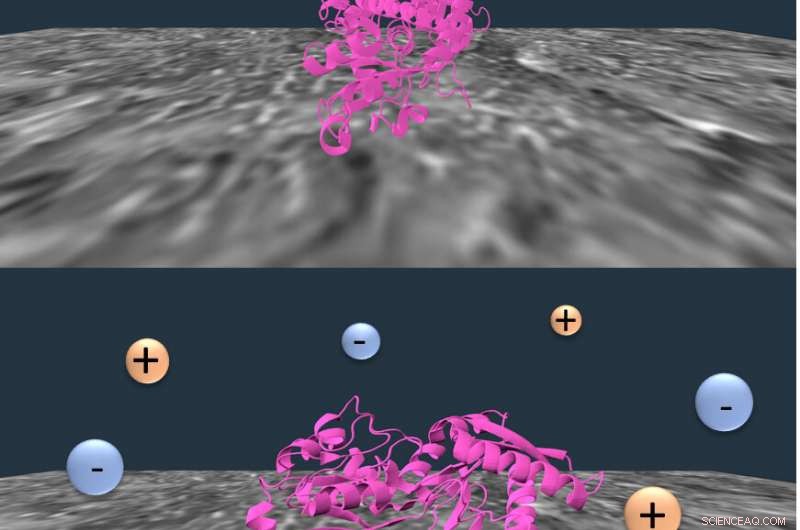
Rice University forskare fann att adsorption av transferrin till nylongränssnittet i kromatografi (överst) inducerar den partiella utveckningen av proteinet (botten). Denna utveckling förstärks i närvaro av salt. Att kontrollera processen kan hjälpa till att bygga bättre modeller för att förutsäga proteinseparation, en kritisk process vid läkemedelstillverkning. Kredit:Landes Research Group/Rice University
Med mycket hårt arbete och en skvätt salt, Rice University-forskare har tagit ett steg mot att förenkla läkemedelstillverkningen.
Riskemist Christy Landes och hennes kollegor rapporterade i Proceedings of the National Academy of Sciences deras strategi att göra polymermembranbaserad separation av proteiner mer effektiv.
"Det kostar cirka 3 miljarder dollar att föra ut ett läkemedel baserat på ett biologiskt protein till konsumenten, ", sade Landes. "Och runt hälften av det kan bero på att rening sker genom försök och misstag. Miljarder dollar slösas bort varje år eftersom det inte finns något sätt att förutsäga utforma ett separationssystem för ett protein."
Rice-labbet utvecklar modeller för att förutsäga hur justering av beteendet hos enskilda proteiner vid membrangränssnitt kommer att påverka separationen.
Genom sin forskning, de upptäckte hur man använder salt för att stämma av två distinkta interaktioner mellan en stationär fas av nylon och ett modellprotein, transferrin, hjälper till att göra separationer effektivare.
Forskarna fokuserade på salt, eftersom "utsaltning" är ett vanligt steg i kromatografi, en industristandardprocess genom vilken elementen i en lösning separeras, eller "renad". Filtren kan vara naturligt material som jord, absorbenter som cellulosa eller, alltmer, polymerer, inklusive nylon.
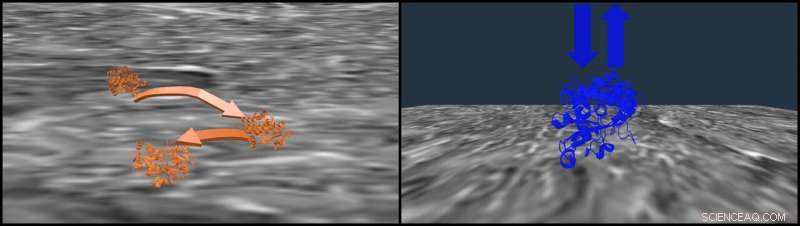
En illustration visar två sätt för transferrin-nylon-interaktion, en "hoppningsmekanism" känd som CTRW (orange) och single-site adsorption-desorption (blå). Rice University kemister visade hur salt modifierar ytinteraktioner i kromatografi som används för att separera läkemedelsproteiner och föreslog att begränsa CTRW-diffusion i den stationära fasen kommer att förbättra separationen. Kredit:Landes Research Group/Rice University
"Tänk på dessa filter som stopp längs en motorväg, " sa medförfattaren Logan Bishop, som kombinerade sina simuleringar med experiment av huvudförfattaren Nicholas Moringo. Båda är National Science Foundation (NSF) graduate fellows vid Rice.
"Det första stoppet skiljer ut de stora riggarna, nästa stopp får pickupen, och så småningom är du bara kvar med de vanliga bilarna du vill ha, " sade biskopen. "Här, vi pratar om alla olika krafter som separerar olika komponenter när en blandning rör sig genom kolonnen."
Upplöst salt skapar solvatiserade joner som interagerar med proteiner och ställer in dem för att antingen stoppa och interagera med kromatografikolonnen eller gå vidare genom kolonnen. I slutet av utsaltning, det önskade proteinet kan extraheras från kolonnen med ett lösningsmedel och göras tillgängligt för ytterligare reningssteg.
Exakt hur saltet påverkar separationen är bara en fråga som forskarna hoppas kunna svara på genom sina experiment och simuleringar. "Det viktigaste vi gjorde i den här artikeln var att kombinera observationer av enskilda proteiner som interagerar vid nylongränssnittet för att förstå exakt hur de interagerar, Landes sa. "Våra simuleringar låter oss nu förutsäga den förbättrade separationseffektiviteten under realistiska förhållanden."
Forskarna identifierade konkurrerande krafter vid nylonytan som kunde stämmas av saltkoncentration. Observationer visade att vikta transferrinproteiner tenderade att hoppa runt nylonet, men de vecklas ut delvis när de väl är fästa vid membranet. Högre saltkoncentrationer utvecklar dem ännu mer, minska hoppningen och tillåta membraninteraktionerna att förbättra separationseffektiviteten.

Nicholas Moringo, vänster, och Logan Bishop, båda National Science Foundation doktorander vid Rice University, diskutera en detalj i deras arbete med att förfina modeller av hur salt modifierar ytinteraktioner i kromatografi som används för att separera värdefulla läkemedelsproteiner. Forskningen kan vara ett steg mot att förenkla läkemedelstillverkningen. Kredit:Jeff Fitlow/Rice University
"Saltet stämmer fördelningen av dessa två sätt att interagera, och det ändrar också strukturen av proteinet vid gränssnittet, ", sa Landes. "Men de är var och en bara en del av tävlingen på mikroskalan som ger dig den makroskopiska effekten. Det är därför det är så dyrt att optimera processen med trial and error."
"Vi skulle vilja kunna testa ett bibliotek av ytkemi under olika förhållanden i ett skott på ett täckglas, så att vi kan identifiera de ideala förutsättningarna för separation, "Sade Moringo. "Då kan vi använda simuleringen för att förutsäga vilket kombinatoriskt svar på ditt chip som kommer att vara det rätta för att optimera separationen."
Det kommer att ta år innan simuleringar inkluderar alla möjliga parametrar, men det är en resa värd att göra för att göra läkemedelsdesign och tillverkning bättre, sa biskopen. "Modellen är inte tillräckligt komplex, och det finns ett argument att vi aldrig kommer att kunna matcha komplexiteten i kromatografiprocessen, ", sa han. "Men vår förhoppning är att vi kan få en tillräckligt nära uppskattning för att börja raka bort några av dessa kostnader och komma närmare en verklig lösning."
Landes noterade att läkemedelsföretagen har bemästrat sina nuvarande tekniker, så långt de går. "Ingen vet bättre än industriingenjörer hur man optimerar en process för att få mest resultat för minsta möjliga summa pengar, så länge de håller sig på den väg de har följt i 70 år, " sa hon. "Men vi går in på en transformativ väg. Det är vad akademisk forskning är till för."