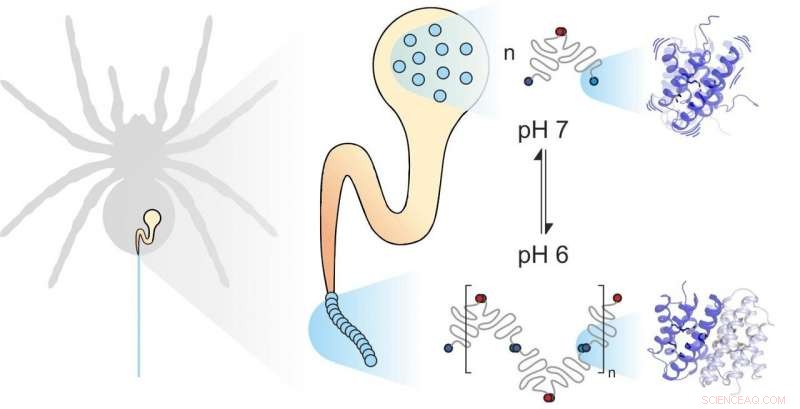
Spindelsilke består av individuella proteiner. Mekaniska och kemiska faktorer påverkar hur de monteras. Dynamiken hos underenheterna spelar en viktig roll. Kredit:Benedikt Goretzki, Ute Hellmich
Spindelsilke består av fiberbildande proteiner, lagras av spindeln i en specialiserad körtel. När spindeln behöver silke, till exempel för att bygga en webb, den extruderar silkesproteinerna genom en lång kanal där de utsätts för specifika mekaniska och kemiska influenser och sätts ihop till silke. Spindelsilkeproteiner, som alla proteiner, består av 20 elementära byggstenar som kallas aminosyror. Antalet och sekvensen av dessa aminosyror bestämmer egenskaperna hos enskilda proteiner. Till exempel, om hydrofoba aminosyror som leucin finns i mitten av ett protein, resultatet är avsevärd strukturell stabilitet. Därför kan du förvänta dig att det extremt starka spindelsilket innehåller mycket leucin. Till deras stora förvåning, dock, forskare från universiteten i Mainz och Würzburg upptäckte att en annan byggsten, metionin, är mycket rikligt i vissa spindelsilkeproteiner.
Metioninsidokedjor är kända för att vara mycket flexibla. "Det var detta överflöd av metionin i spindelsilkeproteinet som fick oss att titta närmare på dess dynamik, " sa professor Ute Hellmich vid Johannes Gutenberg University Mainz (JGU). "Vårt samarbete med teamet av Dr. Hannes Neuweiler vid Julius-Maximilians-Universität Würzburg (JMU) gav oss tillgång till toppmoderna biofysiska forskningsverktyg. "
Würzburggruppen ersatte systematiskt aminosyran metionin i spindelsilkeproteiner med leucin och jämförde veckningen, stabilitet, och dynamik hos de resulterande proteinvarianterna med hjälp av fotoinducerad elektronöverföringsfluorescens-korrelationsspektroskopi (PET-FCS). Dr. Hannes Neuweiler var avgörande i utvecklingen av denna teknik, och hans laboratorium är världsledande när det gäller att använda det för att undersöka biologiska system. Professor Ute Hellmichs team undersökte sedan strukturen och dynamiken hos de två proteinvarianterna med hjälp av högupplöst kärnmagnetisk resonans (NMR) spektroskopi. "Vi genomför våra NMR-mätningar vid Center for Biomolecular Magnetic Resonance vid Goethe University Frankfurt - ett annat exempel på potentialen som genereras av vårt samarbete i Rhen-Main University-nätverket, " betonade Hellmich.
Metioninbyggstenar i spindelsilkeproteiner ger flexibilitet
Kombinationen av PET-FCS och NMR-spektroskopi ledde de två forskargrupperna till den oväntade slutsatsen att metionin i spindelsilkeprotein ökar flexibiliteten i proteinstrukturen, och att denna flexibilitet är just det som gör att de enskilda proteinerna i spindelsilke kan interagera nära. "Vi fann att att ersätta metionin med leucin inte har någon effekt på spindelsilkesproteinstrukturen. Faktum är att båda proteinerna ser exakt likadana ut. På samma gång, dock, det naturliga metioninhaltiga proteinet binder mycket starkare till andra spindelsilkeproteiner. Det leucinhaltiga protein som vi syntetiserade i labbet förlorar till stor del denna förmåga att bilda sådana stabila länkar, " påpekade Benedikt Goretzki, en doktorand i Hellmichs team och en av de två huvudförfattarna till studien publicerad i Naturkommunikation . "Vi blev verkligen förvånade, eftersom detta visar att det inte bara är formen på ett protein som avgör hur det fungerar utan också, i betydande grad, dess flexibilitet."
"Metionin gör inte bara proteinet mer dynamiskt, det förbättrar också dess funktionalitet. I själva verket, det gör det möjligt för två proteiner att specifikt länka samman med varandra, vilket annars skulle vara omöjligt, även om de hade samma struktur, " förtydligade Julia Heiby, doktorand i Neuweilers grupp och den andra huvudförfattaren till studien.
"Form följer funktion" är en tumregel inom strukturbiologin. Med andra ord, vad ett protein vanligtvis gör kan härledas från dess tredimensionella struktur. "Det är imponerande hur naturen också kan påverka proteiners funktion genom att exakt anpassa deras dynamik, ", tillade den Mainz-baserade biokemisten professor Ute Hellmich.
På grundval av dessa fynd, det kan nu vara möjligt att selektivt modifiera egenskaperna hos spindelsilkeproteiner, till exempel, att syntetisera nya mycket stabila biomaterial. Dessutom, de två grupperna hoppas också kunna ge generella insikter om relevansen av proteiners dynamik i förhållande till deras biologiska funktioner. "Proteindynamik är viktig i alla aspekter av livet, ", avslutade Hellmich. "Detta är sant för både spindlar och människor."