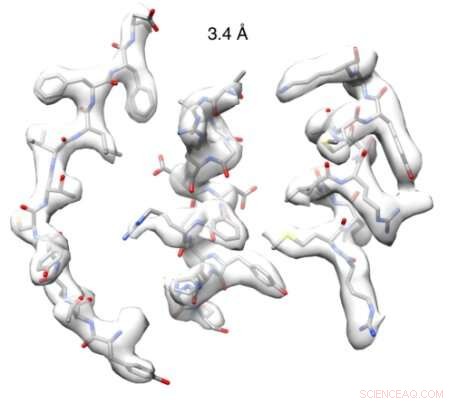
Genom att maskera ett enda spiralformigt varv och behandla detta som en enda partikel, forskarna kunde förbättra upplösningen avsevärt. Kredit:Diamond Light Source
Ett team från Kapstaden har nyligen publicerat den första högupplösta kryoelektronmikroskopi (EM) papper som kommer från Afrika. Som beskrivs i Naturkommunikationsbiologi , teamet löste strukturen för ett nitrilasenzym till en nära atomär upplösning och använde de strukturella insikterna för att designa ett muterat enzym som kunde finjusteras för tillämpningar inom bioteknik. Detta arbete möjliggjordes genom ett åtkomstprogram finansierat av Synchrotron Techniques for African Research and Technology-projektet, ett samarbetsbidrag som syftar till att bygga partnerskap mellan världsledande forskare i Afrika och Storbritannien som arbetar tillsammans om forskning med hjälp av synkrotronvetenskap.
Nitrilaser är en fascinerande klass av växtenzymer som är betydande aktörer i syntesen av ett brett spektrum av viktiga kemikalier. Dessa enzymer har vanligtvis specificitet för ett litet antal substrat, ändå har de en enorm bioteknisk potential. Ett team av vetenskapsmän från University of Cape Town satte sig för att realisera denna potential genom att undersöka strukturen hos enzymerna med hjälp av cryo-EM vid elektronbioavbildningscentret (eBIC).
Efter att ha lyckats få fram högkvalitativ strukturell information, teamet fick en bild med nära atomär upplösning (3,4 Å) av ett nitrilas från kålfamiljen. Med hjälp av denna struktur, teamet designade semi-rationellt ett nytt mutant nitrilas som verkade på substrat som inte katalyserades av några andra naturligt förekommande nitrilaser.
Teamet hoppas att de kan gå vidare med att göra "designer" nitrilaser för alla substrat som industrin behöver – oavsett om det är läkemedel, finkemikalier eller till och med mat. Mer arbete på eBIC planeras för att fortsätta denna fruktbara studie.
Heliska vridningar
Nitrilaser är en klass av enzymer som används för att producera karboxylsyror, ammoniak och amider för storskalig syntes av läkemedel och industriellt viktiga kemikalier. Ett team av forskare från University of Cape Town fascinerades av dessa enzymer och ville studera hur de utvecklades och korrelerar deras struktur och funktion.
Gruppen jämförde initialt två olika nitrilaser från Arabidopsis thaliana (en medlem av kålfamiljen) och såg att man hade ett brett utbud av substrat, men den andra var mycket mer specifik för bara ett litet antal substrat. De utförde en serie mutationer i enzymernas bindningsficka och upptäckte att byte av en enda aminosyra förändrade nitrilasernas substratpreferenser. Med denna lockande kunskap, gruppen bestämde sig för att skaffa detaljerad strukturell information för att avslöja hur nitrilaser plockar sina substrat.
Dr Jeremy Woodward, Föreläsare i medicinsk biokemi vid University of Cape Town och huvudutredare för studien förklarade sin grupps motiv,
"För att försöka ta reda på vad som pågick avbildade vi alla enzymer med lågupplöst cryo-EM vid University of Cape Town och fann att de bildade filament, och att tätheten av deras spiralformade vridning var korrelerad med substratstorleken. Faktiskt, aminosyran vi upptäckte var belägen vid ett gränssnitt mellan två spiralformade subenheter. Vi har observerat denna korrelation med ett stort antal nitrilasenzymer, men kunde inte förklara vad som hände på molekylär nivå förrän vårt senaste besök på eBIC på Diamond Light Source."
Atomnära struktur
Teamet hade tidigare använt negativ färgningselektronmikroskopi (EM) som är begränsad till en upplösning på 20 Å, och är inte tillräckligt hög för att se atomdetaljer i strukturen. Dessutom, tidigare arbete från andra laboratorier hade visat att nitrilaser inte kan kristalliseras, så cryo-EM var deras enda alternativ.
"Detta var den enda metoden som kunde användas för att svara på frågorna som de hade, " förklarade Dr Adriana Klyszejko, postdoktoral forskarassistent vid eBIC som hjälpte till med studien. "På Diamond, vad vi har skapat är en integrerad satsning på vår användargemenskap där de kan driva sin forskning vidare."
På eBIC, teamet fick en struktur med en upplösning på 3,4 Å. Dr Woodward, utarbetat:
"Den höga kvaliteten på data vi erhöll gjorde det möjligt för oss att visualisera strukturen av en intakt nitrilas spiralformad filament med nära atomär upplösning för första gången. Vi observerade en slinga, hålls på plats av aminosyran vi upptäckte, som begränsar den maximala storleken på bundna substrat och skiftar med spiralformad vridning."
START-bidraget
Arbetet möjliggjordes med ett Synchrotron Techniques for African Research and Technology (START)-anslag; ett initiativ som inrättades i mars 2019 för att bygga partnerskap mellan forskare i Afrika och Storbritannien. START finansieras av ett anslag på 3,7 miljoner pund från UKRI:s Science and Technology Facilities Council (STFC) från Global Challenges Research Fund (GCRF). STFC tilldelade finansieringen från GCRF, en femårig fond på 1,5 miljarder pund som är en nyckelkomponent i leveransen av den brittiska biståndsstrategin, se till att brittisk forskning tar en ledande roll när det gäller att ta itu med de problem som utvecklingsländerna står inför genom forskning och innovation.
Motivationen för START kommer från de samhälleliga utmaningar som afrikanska samhällen står inför; till exempel, 600 miljoner människor (70 %) i Afrika söder om Sahara lever utan elektricitet, och en pålitlig elförsörjning är ett av de mest kraftfulla verktygen för att lyfta människor ur fattigdom och sluta deras beroende av bistånd. START-forskare kommer att undersöka energimaterial, inklusive solcellsstrukturer, katalysatorer och batterier. Utvecklingen av sjukvården i Afrika hämmas av bristande grundläggande förståelse för orsaken till sjukdomar som malaria eller HIV. Strukturbiologi ger oöverträffad insikt i mekanismerna bakom sådana sjukdomar.
Förutom att ge tillgång till anläggningarna i världsklass på eBIC till forskarna från Sydafrika, anslaget stödde också postdoktorala forskare, Dr. Andani Mulelu som var studiens ledande utredare. "Detta arbete hade inte varit möjligt utan detta, eftersom utrustningen, stöd och infrastruktur som krävs för att framgångsrikt genomföra detta experiment är inte tillgängligt i Afrika, " förklarade Dr Woodward.
Dr Gwyndaf Evans, Huvudstrållinjeforskare på Diamonds VMXm strållinje, och Life Sciences huvudutredare för START-projektet kommenterar:
"Start-initiativet syftar till bland annat, att hjälpa till att bygga upp expertis och kapacitet för strukturbiologi i Afrika. Inledningsvis lägger vi tonvikt på att underlätta tillgången till Diamonds strukturella biologianläggningar genom fokuserade utbildningar i Sydafrika och lokalt här på Diamond. Det yttersta målet är att visa för afrikanska finansiärer kraften och fördelarna med strukturbiologi för att ta itu med afrikanska problem inom människors hälsa och jordbruk för att göra strukturbiologi till en hållbar aktivitet på kontinenten. Att se experter som Jeremy Woodward uppnå en fast position i Sydafrika bådar gott för framtiden och går en bit på väg för att bygga denna hållbarhet."
Designer nitrilaser
Med hjälp av insikterna från den högupplösta cryo-EM-strukturen, laget granskade över 5, 000 mutanter för att designa ett nytt enzym med en förändrad spiralvridning som verkar på en ny uppsättning substrat som inte katalyseras av några andra växtnitrilaser. Detta utfördes genom att identifiera "hotspot"-aminosyror för riktad evolution och selektera dem genom att koppla överlevnaden av bakterier till en framgångsrik omvandling av ett bibliotek av substrat.
Att bygga vidare på detta arbete, teamet hoppas kunna finjustera nitrilaser för att realisera sin fulla biotekniska potential. "Vi skulle vilja komma till den punkt där vi kan producera "designer" nitrilaser för alla substrat genom att göra lämpliga ändringar av den spiralformade vridningen såväl som bindningsfickan. För att uppnå detta, vi skulle vilja visualisera en samling nyckelnitrilaser med en rad olika spiralformade tillstånd (och substratspecificiteter) med högupplöst cryo-EM, avslutade Prof Woodward.