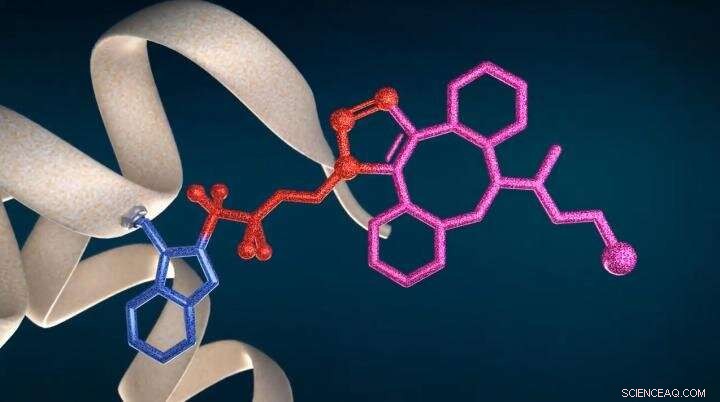
Ny teknologi CF LINK för proteinbiokonjugation och strukturell proteomik Kredit:IOCB Prag (Källa:youtu.be/a9IMvKv0UQU)
Forskare vid den tjeckiska vetenskapsakademin och den Brno-baserade nystartade CF Plus Chemicals, en spin-off av ETH Zürich, har rapporterat en ny teknologi som kallas CF LINK för platsselektiv biokonjugering av proteiner och deras strukturella karakterisering. Tekniken kan selektivt framställa proteinkonjugat via deras tryptofanrester och utföra posttranslationell modifiering av aromatiska aminosyror. Vidare, den kan också användas som ett verktyg för kartläggning av proteinytor och studier av protein-proteininteraktioner.
Företaget CF Plus Chemicals, en ETH Zürich spin-off grundad 2014, är baserad på nästan 10 års samarbete mellan Dr. Petr Beiers grupp vid Institutet för organisk kemi och biokemi vid Tjeckiska vetenskapsakademin (IOCB Prag) och Dr. Václav Matoušek, en Ph.D. alumn till Prof. Dr. Antonio Togni vid ETH Zürich.
Reagens baserade på cykliska hypervalenta jod-perfluoroalkylföreningar, även kallade Togni-reagenser, har blivit mycket använda och populära verktyg inom organisk syntes, speciellt inom medicinsk kemi för beredning av nya fluorerade läkemedelskandidater, i linje med den växande efterfrågan på fluorerade ställningar inom läkemedelsdesign. I början av 1990-talet fluorerade molekyler stod för 5 procent av det totala antalet godkända läkemedel; de utgör nu 15 procent, och ungefär 30 procent för nyligen godkända terapier.
Denna familj av kemiska föreningar utökades sedan 2013 i samarbete med ETH Zurich och Dr. Petr Beier från IOCB till en ny generation av patenterade Togni-reagenser som bär en mer komplex RCF2CF2-grupp istället för en enkel CF3-grupp. Den nya familjen av dessa kemikalier delar inte bara den rika reaktiviteten hos den första generationens Togni-reagens, men uppvisar också praktiskt taget obegränsad strukturell variation av den β-substituerade tetrafluoretylgruppen, som de kan överföra till en mängd olika substrat som är relevanta för medicinsk kemi av små molekyler.
Under 2017, tillämpningspotentialen för den andra generationen av Togni-reagens utvidgades till proteiner. Deras höga affinitet mot tiolgruppen tillåter selektiv biokonjugering genom cysteiner för att bilda stabila konjugat som, till skillnad från maleimidkonjugat, är inte föremål för långsam dekonjugering och tiolutbyte.
Föreliggande uppfinning bygger på den tidigare kunskapen om den radikala naturen hos Togni-reagensförmedlade reaktioner. I SME Instrument Horizon 2020-projektet, med stöd av staden Brno och i samarbete med IOCB och Dr. Petr Novák från Institutet för mikrobiologi vid den tjeckiska vetenskapsakademin (IMIC), det visades att Togni-reagenser, när det blandas med natriumaskorbat, en billig, ogiftigt och biokompatibelt reduktionsmedel, generera omedelbart ß-substituerade tetrafluoretylradikaler som selektivt fäster till steriskt tillgängliga tryptofanrester av proteinet under övergångsmetallfria förhållanden.
När azidofluoralkylgrupper är fästa till proteinet, olika funktionsgrupper, såsom fluorescerande färgämnen, radionuklider eller ADC-toxiner för riktad onkoterapi kan därefter länkas via klickreaktion för att ge motsvarande proteinkonjugat. Den beskrivna tryptofanselektiva biokonjugeringsmetoden stör inte proteindisulfidbryggor och erbjuder en alternativ lösning där konventionell cysteinkonjugering inte är möjlig, till exempel, på grund av en oönskad disulfidförvrängning.
Denna biokonjugeringsmetod kan även utvidgas till andra aromatiska aminosyror och följaktligen till proteiner som saknar tryptofan. Således, det var möjligt att framgångsrikt modifiera humant rekombinant insulin och fästa upp till sju modifieringar till dess aromatiska aminosyror, demonstrerar potentialen för posttranslationell modifiering av proteiner.
Den extremt snabba karaktären hos denna reaktion som är inriktad på lösningsmedelstillgängliga aromatiska aminosyror gör den till ett bekvämt verktyg för att kartlägga proteinytor och studera protein-proteininteraktioner. Med hjälp av exemplet med humant kolanhydras, forskarna visade att resultaten av ytkartering stämmer utmärkt överens med dess publicerade inhemska struktur.
Prof. Dr. Martin Fusek, VD för IOCB Tech, säger, "Grunden för framgångsrika kommersiella resultat från grundforskningsresultat är utmärkt vetenskapligt arbete. Detta är ett viktigt resultat som inte bara är användbart som ett verktyg för grundforskning utan också som ett medel för utveckling av nya proteinbaserade läkemedel. Det unika, vilket snarare borde vara regeln, är att projektet skapades i samarbete mellan två akademiska institutioner och ett kommersiellt företag. Jag är väldigt glad att vi kunde ha varit en del av processen."
Dr Petr Beier, chef för en forskargrupp vid IOCB Prag, säger, "Jag är glad att vi har kunnat utveckla ett framgångsrikt tvärvetenskapligt samarbete av organisk syntes och biokemi. Det visar sig att de specifika egenskaperna hos fluorerade föreningar kan utnyttjas inte bara traditionellt i den medicinska kemin av små molekyler, men som nyligen visat också för biokonjugering av proteiner och studier av deras struktur. Jag tror att vi i framtiden kommer att kunna identifiera andra attraktiva användningsområden för Togni-reagenser inom biokemi."
Dr Petr Novák, chef för en forskargrupp vid IMIC, säger, "Tack vare Togni-reagenser har vi kunnat introducera en fluorerad sond i proteinstrukturen i en vattenhaltig miljö på några sekunder. Vi kan nu använda denna teknologi för att selektivt tagga proteiner för klinisk diagnostik eller använda den för att identifiera interaktionsgränssnittet mellan proteiner och deras ligander."
Dr Václav Matoušek, VD för CF Plus Chemicals, säger, "Jag är glad över att se att reaktiviteten hos Togni-reagenser kan utökas till aromatiska aminosyror och aromater i allmänhet, vilket öppnar en uppsjö av potentiella applikationer, speciellt inom proteinvetenskap och proteinbaserad terapi. Vi letar nu aktivt efter etablerade industriella partners som kan tillämpa vår teknik för att lösa sina utmaningar."