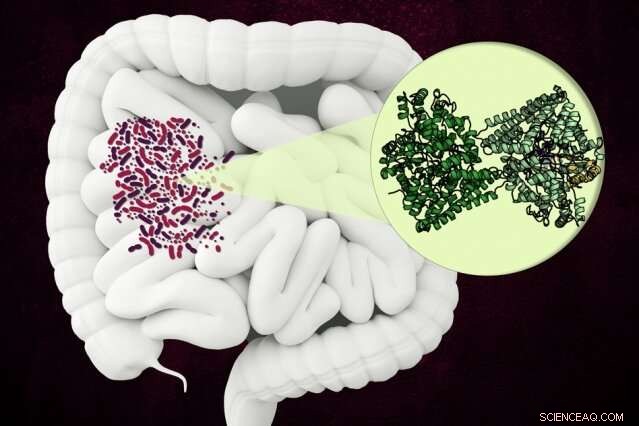
MIT-forskare har upptäckt strukturen hos ett ovanligt enzym som vissa mikrober använder för att bryta ner en komponent av kollagen i människans tarm. Kredit:Christine Daniloff, MIT
Kemister från MIT och Harvard University har upptäckt strukturen hos ett ovanligt bakteriellt enzym som kan bryta ner en aminosyra som finns i kollagen, vilket är det vanligaste proteinet i människokroppen.
Enzymet, känd som hydroxy-L-proline dehydratas (HypD), har hittats i några hundra arter av bakterier som lever i människans tarm, Inklusive Clostridioides difficile . Enzymet utför en ny kemisk reaktion som demonterar hydroxi-L-prolin, molekylen som ger kollagen dess sega, trippelhelixstruktur.
Nu när forskarna känner till enzymets struktur, de kan försöka utveckla läkemedel som hämmar det. Ett sådant läkemedel kan vara användbart vid behandling C. difficile infektioner, som är resistenta mot många befintliga antibiotika.
"Det här är väldigt spännande eftersom det här enzymet inte finns hos människor, så det kan vara ett potentiellt mål, säger Catherine Drennan, en MIT-professor i kemi och biologi och en utredare vid Howard Hughes Medical Institute. "Om du potentiellt kunde hämma det enzymet, det kan vara ett unikt antibiotikum."
Drennan och Emily Balskus, professor i kemi och kemisk biologi vid Harvard University, är seniorförfattarna till studien, som finns i dagboken idag eLife . MIT doktorand Lindsey Backman och tidigare Harvard doktorand Yolanda Huang är huvudförfattarna till studien.
En svår reaktion
HypD-enzymet är en del av en stor familj av proteiner som kallas glycylradikalenzymer. Dessa enzymer fungerar på ett ovanligt sätt, genom att omvandla en molekyl av glycin, den enklaste aminosyran, till en radikal – en molekyl som har en oparad elektron. Eftersom radikaler är mycket instabila och reaktiva, de kan användas som kofaktorer, som är molekyler som hjälper till att driva en kemisk reaktion som annars skulle vara svår att utföra.
Dessa enzymer fungerar bäst i miljöer som inte har mycket syre, som den mänskliga tarmen. Human Microbiome Project, som har sekvenserat tusentals bakteriegener från arter som finns i människans tarm, har gett flera olika typer av glycylradikalenzymer, inklusive HypD.
I en tidigare studie, Balskus och forskare vid Broad Institute of MIT och Harvard upptäckte att HypD kan bryta ner hydroxi-L-prolin till en prekursor för prolin, en av de essentiella aminosyrorna, genom att ta bort hydroximodifieringen som en vattenmolekyl. Dessa bakterier kan i slutändan använda prolin för att generera ATP, en molekyl som celler använder för att lagra energi, genom en process som kallas aminosyrafermentering.
HypD har hittats i cirka 360 arter av bakterier som lever i människans tarm, och i denna studie, Drennan och hennes kollegor använde röntgenkristallografi för att analysera strukturen av versionen av HypD som finns i C. difficile . Under 2011, denna bakterieart var ansvarig för ungefär en halv miljon infektioner och 29, 000 dödsfall i USA.
Forskarna kunde avgöra vilken region av proteinet som utgör enzymets "aktiva plats, " vilket är där reaktionen inträffar. När väl hydroxi-L-prolin binder till det aktiva stället, en närliggande glycinmolekyl bildar en glycylradikal som kan passera den radikalen till hydroxi-L-prolinen, leder till eliminering av hydroxigruppen.
Att ta bort en hydroxigrupp är vanligtvis en svår reaktion som kräver en stor insats av energi.
"Genom att överföra en radikal till hydroxi-L-prolin, det sänker den energiska barriären och gör att reaktionen kan inträffa ganska snabbt, " säger Backman. "Det finns inget annat känt enzym som kan utföra den här typen av kemi."
Nytt läkemedelsmål
Det verkar som att när bakterier utför denna reaktion, de avleder prolin till sina egna metaboliska vägar för att hjälpa dem att växa. Därför, blockering av detta enzym kan bromsa bakteriens tillväxt. Detta kan vara en fördel vid kontroll C. difficile , som ofta finns i små mängder i människans tarm men kan orsaka sjukdom om populationen blir för stor. Detta inträffar ibland efter antibiotikabehandling som utplånar andra arter och tillåter C. difficile att föröka sig.
" C. difficile kan vara i tarmen utan att orsaka problem – det är när du har för mycket av det jämfört med andra bakterier som det blir mer problematiskt, Drennan säger. tanken är att genom att rikta in sig på detta enzym, du kan begränsa resurserna C. difficile , utan att nödvändigtvis döda den."
Forskarna hoppas nu kunna börja designa läkemedelskandidater som kan hämma HypD, genom att rikta in sig på de element i proteinstrukturen som verkar vara de viktigaste för att utföra dess funktion.