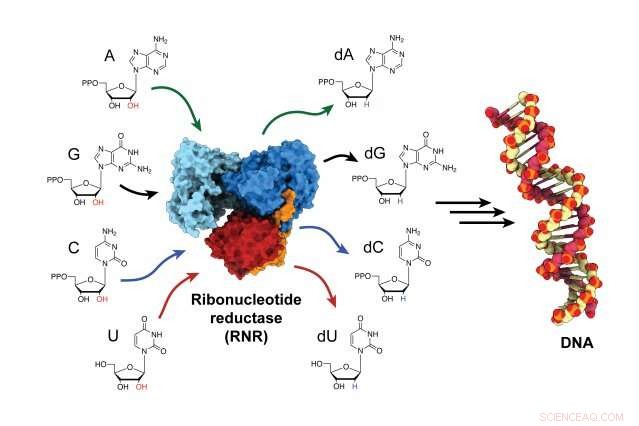
Enzymet ribonukleotidreduktas (RNR) är ansvarigt för att omvandla RNA-byggstenar till DNA-byggstenar, och är en kritisk aktör i både DNA-syntes och reparation i alla organismer. Kredit:Gyunghoon "Kenny" Kang
Hur fångar man en cellulär process som sker på ett ögonblick? Biokemister vid MIT har utarbetat ett sätt att fånga och visualisera ett livsviktigt enzym i det ögonblick det blir aktivt – informera läkemedelsutveckling och avslöja hur biologiska system lagrar och överför energi.
Enzymet, ribonukleotidreduktas (RNR), är ansvarig för att omvandla RNA-byggstenar till DNA-byggstenar, för att bygga nya DNA-strängar och reparera gamla. RNR är ett mål för anti-cancerterapier, samt läkemedel som behandlar virussjukdomar som HIV/AIDS. Men i decennier, forskare kämpade för att avgöra hur enzymet aktiveras eftersom det händer så snabbt. Nu, för första gången, Forskare har fångat enzymet i dess aktiva tillstånd och observerat hur enzymet ändrar form, föra dess två underenheter närmare varandra och överföra den energi som behövs för att producera byggstenarna för DNA-sammansättning.
Före denna studie, många trodde att RNR:s två underenheter kom ihop och passade med perfekt symmetri, som en nyckel i ett lås. "I 30 år, det var vad vi trodde, säger Catherine Drennan, en MIT-professor i kemi och biologi och en utredare vid Howard Hughes Medical Institute. "Men nu, vi kan se att rörelsen är mycket mer elegant. Enzymet utför faktiskt en "molekylär kvadratdans, ' där olika delar av proteinet hakar på och svänger runt andra delar. Det är verkligen ganska vackert."
Drennan och JoAnne Stubbe, professor emerita i kemi och biologi vid MIT, är seniorförfattarna till studien, som förekom i tidskriften Vetenskap den 26 mars. Tidigare doktorand Gyunghoon "Kenny" Kang Ph.D. '19 är huvudförfattaren.
Alla proteiner, inklusive RNR, består av grundläggande enheter som kallas aminosyror. I över ett decennium, Stubbes labb har experimenterat med att ersätta RNR:s naturliga aminosyror med syntetiska. Genom att göra så, labbet insåg att de kunde fånga enzymet i dess aktiva tillstånd och bromsa dess återgång till det normala. Dock, det var inte förrän Drennan-labbet fick tillgång till en viktig teknisk framgång – kryoelektronmikroskopi – som de kunde ta högupplösta bilder av dessa "fångade" enzymer från Stubbe-labbet och få en närmare titt.
"Vi hade verkligen inte gjort någon kryo-elektronmikroskopi vid den punkt då vi aktivt började försöka göra det omöjliga:få strukturen av RNR i dess aktiva tillstånd, Drennan säger. "Jag kan inte fatta att det fungerade; Jag nyper mig fortfarande."
Kombinationen av dessa tekniker gjorde det möjligt för teamet att visualisera den komplexa molekylära dansen som gör att enzymet kan transportera den katalytiska "eldkraften" från en underenhet till nästa, för att generera DNA-byggstenar. Denna eldkraft kommer från en mycket reaktiv oparad elektron (en radikal), som måste kontrolleras noggrant för att förhindra skador på enzymet.
Enligt Drennan, laget "ville se hur RNR gör motsvarigheten till att leka med eld utan att bli bränd."
Förstaförfattaren Kang säger att genom att bromsa den radikala överföringen kunde de observera delar av enzymet som ingen hade kunnat se i sin helhet. "Innan denna studie, vi visste att den här molekylära dansen höll på att hända, men vi hade aldrig sett dansen i aktion, " säger han. "Men nu när vi har en struktur för RNR i dess aktiva tillstånd, vi har en mycket bättre uppfattning om hur de olika komponenterna i enzymet rör sig och interagerar för att överföra radikalen över långa avstånd."
Även om denna molekylära dans sammanför underenheterna, det är fortfarande avsevärt avstånd mellan dem:Radikalen måste färdas 35-40 ångström från den första subenheten till den andra. Denna resa är ungefär 10 gånger längre än den genomsnittliga radikala överföringen, enligt Drennan. Radikalen måste sedan resa tillbaka till sin startplats och förvaras säkert, allt inom en bråkdel av en sekund innan enzymet återgår till sin normala konformation.
Eftersom RNR är ett mål för läkemedel som behandlar cancer och vissa virus, Att känna till dess aktiva tillståndsstruktur skulle kunna hjälpa forskare att utveckla mer effektiva behandlingar. Att förstå enzymets aktiva tillstånd kan också ge insikt i biologisk elektrontransport för applikationer som biobränslen. Drennan och Kang hoppas att deras studie kommer att uppmuntra andra att fånga flyktiga cellulära händelser som har varit svåra att observera tidigare.
"Vi kan behöva omvärdera årtionden av tidigare resultat, Drennan säger. "Denna studie kan öppna fler frågor än den svarar; det är mer en början än ett slut."
Den här historien återpubliceras med tillstånd av MIT News (web.mit.edu/newsoffice/), en populär webbplats som täcker nyheter om MIT-forskning, innovation och undervisning.