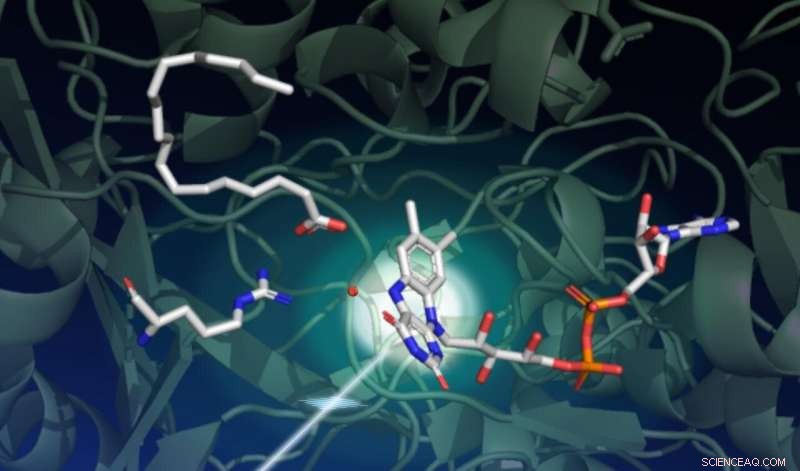
En studie med SLAC:s LCLS röntgenlaser fångade hur ljus driver en serie komplexa strukturella förändringar i ett enzym som kallas FAP, som katalyserar omvandlingen av fettsyror till utgångsbeståndsdelar för lösningsmedel och bränslen. Denna ritning fångar starttillståndet för den katalytiska reaktionen. Den mörkgröna bakgrunden representerar proteinställningen. Enzymets ljusavkännande del, kallad FAD -kofaktorn, visas i mitten till höger med dess tre ringar som absorberar en foton som kommer från nedre vänster. En fettsyra uppe till vänster väntar på omvandling. Aminosyran som visas i mitten till vänster spelar en viktig roll i den katalytiska cykeln, och den röda pricken nära mitten är en vattenmolekyl. Upphovsman:Damien Sorigue/Universite Aix-Marseille
Även om många organismer fångar upp och reagerar på solljus, enzymer - proteiner som katalyserar biokemiska reaktioner - drivs sällan av ljus. Forskare har hittills bara identifierat tre typer av naturliga fotoenzymer. Den nyaste, upptäcktes 2017, är fettsyrafotokarboxylas (FAP). Ursprunget från mikroskopiska alger, det använder blått ljus för att katalysera omvandlingen av fettsyror, finns i fetter och oljor, i alkaner och alkener.
"Ett växande antal labb föreställer sig att använda FAP:er för grön kemiapplikationer, eftersom alkaner och alkener är viktiga komponenter i lösningsmedel och bränslen, inklusive bensin och flygbränsle. Och omvandlingen av fettsyror till alkaner eller alkener sker i ett enda steg i enzymet, "säger Martin Weik, ledare för en forskargrupp vid Institute of Biologie Structurale vid Universite Grenoble Alpes.
Weik är en primär utredare av en ny studie som har fångat den komplexa sekvensen av strukturella förändringar FAP genomgår som svar på ljus, kallas en fotocykel, som driver denna fettsyraomvandling. Även om forskare tidigare föreslog en FAP -fotocykel, den grundläggande mekanismen förstods inte. Forskarna visste inte hur lång tid det tog en fettsyra att tappa karboxylatet, den kemiska gruppen fäst vid slutet av sin långa kedja av kolväten, ett kritiskt steg för att bilda alkener eller alkaner.
I samarbete med SLAC-forskare, experiment vid Linac Coherent Light Source (LCLS) vid Department of Energy:s SLAC National Accelerator Laboratory hjälpte till att svara på många av dessa enastående frågor. Forskarna beskriver sina resultat i Vetenskap .
Alla verktyg i en verktygslåda
För att förstå ett ljuskänsligt enzym som FAP, forskare använder många olika tekniker för att studera processer som äger rum över ett brett spektrum av tidsskalor - eftersom fotonabsorption sker på femtosekunder, eller miljondelar av en miljarddel av en sekund, medan biologiska svar på molekylär nivå ofta sker i tusendels sekunder.
"Vår internationella, tvärvetenskapligt konsortium, ledd av Frederic Beisson vid Université Aix-Marseille, använde en mängd tekniker, inklusive spektroskopi, kristallografi och beräkningsmetoder, "Weik säger." Det är summan av dessa olika resultat som gjorde att vi fick en första glimt av hur detta unika enzym fungerar som en funktion av tid och i rymden. "
Konsortiet studerade först de komplexa stegen i den katalytiska processen på sina hemlaboratorier med hjälp av optiska spektroskopimetoder, som undersöker den elektroniska och geometriska strukturen för atomer i proverna, inklusive kemisk bindning och laddning. Spektroskopiska experiment identifierade enzymets mellanliggande tillstånd som åtföljde varje steg, mätte deras livstid och gav information om deras kemiska natur. Dessa resultat motiverade behovet av de ultrasnabba funktionerna hos LCLS.
Nästa, en strukturell vy av den katalytiska processen tillhandahålls genom seriell femtosekundkristallografi (SFX) med LCLS röntgenfri elektronlaser (XFEL). Under dessa experiment, en stråle av små FAP -mikrokristaller träffades med optiska laserpulser för att starta den katalytiska reaktionen, följt av extremt korta, ultraljusa röntgenpulser för att mäta de resulterande förändringarna i enzymets struktur.
Genom att integrera tusentals av dessa mätningar-förvärvade med olika tidsfördröjningar mellan de optiska och röntgenpulserna-kunde forskarna följa strukturella förändringar i enzymet över tid. De bestämde också strukturen för enzymets vilotillstånd genom att sondera utan den optiska lasern.
Förvånande, forskarna fann att i viloläge, enzymets ljuskänsliga del, kallas FAD-kofaktorn, har en böjd form. "Denna kofaktor fungerar som en antenn för att fånga fotoner. Den absorberar blått ljus och initierar den katalytiska processen, "Weik säger." Vi trodde att utgångspunkten för FAD -kofaktorn var plan, så denna böjda konfiguration var oväntad."
Den böjda formen av FAD-kofaktorn upptäcktes faktiskt först av röntgenkristallografi vid European Synchrotron Radiation Facility, men forskarna misstänkte att denna böj var en artefakt av strålningsskada, ett vanligt problem för kristallografiska data som samlats in vid synkrotronljuskällor. Endast SFX -experiment kunde bekräfta denna ovanliga konfiguration på grund av deras unika förmåga att fånga strukturell information innan de skadade provet, Säger Weik.
"Dessa experiment kompletterades med beräkningar, " han lägger till, "Utan kvantberäkningarna på hög nivå utförda av Tatiana Domratcheva vid Moskvas statliga universitet, vi skulle inte ha förstått våra experimentella resultat."
Nästa steg
Trots den förbättrade förståelsen för FAP:s fotocykel, obesvarade frågor kvarstår. Till exempel, forskare vet att koldioxid bildas under ett visst steg i den katalytiska processen vid en viss tid och plats, men de vet inte dess tillstånd när det lämnar enzymet.
"I framtida XFEL -arbete, vi vill identifiera produkternas natur och ta bilder av processen med en mycket mindre stegstorlek för att lösa processen i mycket finare detalj, " säger Weik. "Detta är viktigt för grundforskning, men det kan också hjälpa forskare att modifiera enzymet för att utföra en uppgift för en specifik tillämpning."