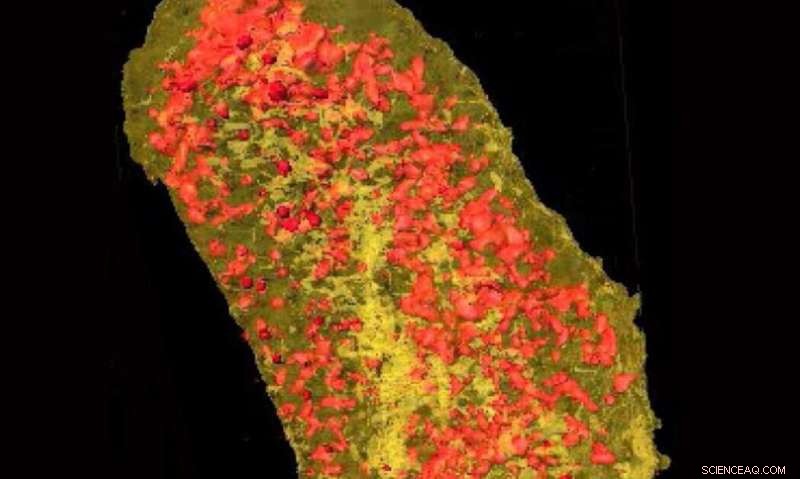
Ultraljusa röntgenstrålar avslöjade koncentrationen av erbium (gul) och zink (röd) i en enda E.coli-cell som uttryckte en lantanidbindande tagg och inkuberad med erbium. Kredit:Brookhaven National Laboratory
Ett team av forskare, inklusive forskare vid National Synchrotron Light Source II (NSLS-II) – ett US Department of Energy (DOE) Office of Science User Facility vid DOE:s Brookhaven National Laboratory – har demonstrerat en ny teknik för att avbilda proteiner i 3-D med nanoskala upplösning. Deras arbete, publiceras i Journal of the American Chemical Society , gör det möjligt för forskare att identifiera den exakta platsen för proteiner i enskilda celler, nå upplösningen av cellmembranet och de minsta subcellulära organellerna.
"I den strukturella biologivärlden, forskare använder tekniker som röntgenkristallografi och kryoelektronmikroskopi för att lära sig om proteiners exakta struktur och härleda deras funktioner, men vi lär oss inte var de fungerar i en cell, " sa motsvarande författare och NSLS-II-forskare Lisa Miller. "Om du studerar en viss sjukdom, du måste veta om ett protein fungerar på fel ställe eller inte alls."
Den nya teknik som utvecklats av Miller och hennes kollegor liknar i stil traditionella metoder för fluorescensmikroskopi inom biologi, där en molekyl som kallas grönt fluorescerande protein (GFP) kan fästas på andra proteiner för att avslöja deras plats. När GFP utsätts för UV eller synligt ljus, det fluorescerar en klar grön färg, belyser ett annars "osynligt" protein i cellen.
"Med GFP, vi kan se om ett protein är i subcellulära strukturer som är hundratals nanometer stora, som kärnan eller cytoplasman, "Miller sa, "men strukturer som ett cellmembran, som bara är sju till 10 nanometer i storlek, är svåra att se med synliga ljustaggar som GFP. För att se strukturer av storleken 10 nanometer i en cell, du har stor nytta av användningen av röntgenstrålar."
För att övervinna denna utmaning, forskare vid NSLS-II slog sig ihop med forskare vid Massachusetts Institute of Technology (MIT) och Boston University (BU) som utvecklade en röntgenkänslig tagg som kallas en lantanidbindande tagg (LBT). LBT är mycket små proteiner som kan binda tätt till grundämnen i lantanidserien, såsom erbium och europium.
"Till skillnad från GFP, som fluorescerar när de utsätts för UV eller synligt ljus, lantanider fluorescerar i närvaro av röntgenstrålar, " sa huvudförfattaren Tiffany Victor, en forskarassistent vid NSLS-II. "Och eftersom lantanider inte förekommer naturligt i cellen, när vi ser dem med röntgenmikroskopet, vi vet platsen för vårt protein av intresse."
Forskarna vid NSLS-II, MIT, och BU arbetade tillsammans för att kombinera LBT-teknik med röntgenfluorescens.
"Även om LBT har använts flitigt under det senaste decenniet, de har aldrig använts för röntgenfluorescensstudier, sa Miller.
Ultraljusa röntgenstrålar avslöjade koncentrationen av erbium (gul) och zink (röd) i en enda E.coli-cell som uttryckte en lantanidbindande tagg och inkuberad med erbium. Kredit:Brookhaven National Laboratory
Förutom att få bilder med högre upplösning, Röntgenfluorescens ger samtidigt kemiska bilder på alla spårämnen i en cell, som kalcium, kalium, järn, koppar, och zink. I andra studier, Millers team forskar om hur spårämnen som koppar är kopplade till neurondöd i sjukdomar som Alzheimers. Att visualisera platsen för dessa element i förhållande till specifika proteiner kommer att vara nyckeln till nya rön.
Förutom deras kompatibilitet med röntgenstrålar, LBT är också fördelaktiga för sin relativt lilla storlek, jämfört med synliga ljustaggar.
"Föreställ dig att du hade en svans fäst vid dig som var lika stor som hela din kropp, eller större, " sade Miller. "Det skulle finnas många normala aktiviteter som du inte längre skulle kunna göra. Men om du bara behövde gå runt med en liten gris svans, du kan fortfarande springa, hoppa, och passa genom dörröppningar. GFP är som den stora svansen - det kan vara ett verkligt hinder för funktionen hos många proteiner. Men dessa små lantanidbindande taggar är nästan osynliga."
För att demonstrera användningen av LBT för avbildning av proteiner i 3-D med nanoskala upplösning, forskarna vid MIT och BU märkte två proteiner i en bakteriecell – ett cytoplasmatiskt protein och ett membranprotein. Sedan, Millers team studerade provet vid Hard X-ray Nanoprobe (HXN) strållinjen vid NSLS-II och Bionanoprobe beamline vid Advanced Photon Source (APS) - en DOE Office of Science User Facility vid DOE:s Argonne National Laboratory.
"HXN erbjuder den världsledande röntgenfokusstorleken, vilket går ner till cirka 12 nanometer. Detta var avgörande för att avbilda bakteriecellen i 3-D med upplösning i nanoskala, " sa Yong Chu, ledande strållinjeforskare vid HXN. "Vi utvecklade också ett nytt sätt att montera cellerna på en specialiserad provhållare för att optimera effektiviteten i mätningarna."
Genom att koppla den oöverträffade upplösningen hos HXN med kapaciteten hos LBT, teamet kunde avbilda båda de märkta proteinerna. Genom att visualisera cellmembranproteinet kan bevisade LBT:er ses i hög upplösning, medan avbildning visade det cytoplasmatiska proteinet att LBT också kunde visualiseras i cellen.
"Vid höga koncentrationer, lantanider är giftiga för celler, " sa Victor, "så det var viktigt för oss att visa att vi kunde behandla celler med en mycket låg lantanidkoncentration som var ogiftig och tillräckligt stor för att ta sig förbi cellmembranet och avbilda de proteiner vi ville se."
Nu, med denna nya teknik demonstrerad framgångsrikt, forskare hoppas kunna använda LBT för att avbilda andra proteiner i cellen med en upplösning på 10 nanometer.