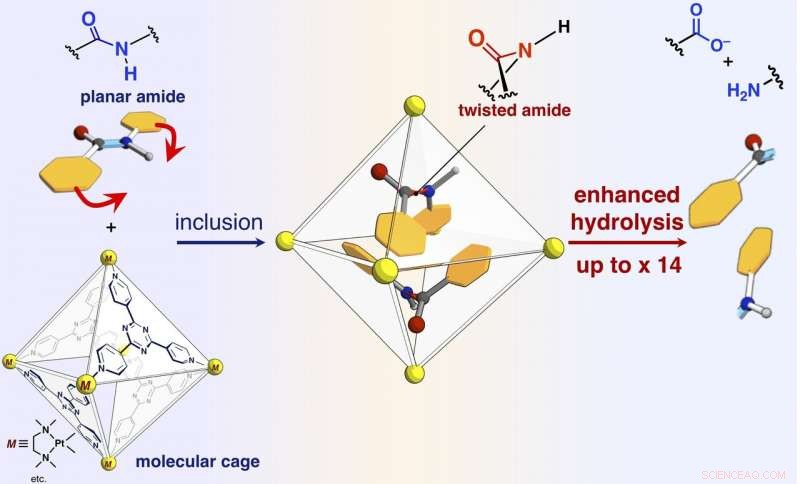
Ett schema för reaktionshastighetsacceleration av amidhydrolys genom inkludering i den självmonterade molekylära buren. Kredit:NINS/IMS
Proteiner är sammansatta av aminosyror sammankopplade med amidbindningar. Amidbindningen uppvisar hög kemisk stabilitet och har en plan struktur runt bindningen. Även om den höga stabiliteten hos amidbindningen är oumbärlig för att bibehålla proteinfunktioner, det är problematiskt att omvandla byggstenen till någon annan molekylär art genom selektiv dissociation av en relevant amidbindning.
Det har gjorts försök att kontrollera reaktiviteten hos en specifik amidbindning via selektiv vridning genom komplicerade kemiska modifieringar. Vissa modellföreningar med tvinnade amidbindningar har framställts genom flerstegs organisk syntes, och deras höga reaktivitet har visats. Det antas att den höga reaktiviteten hos dessa tvinnade amidbindningar också används in vivo. Vissa proteiner verkar vara selektivt klyvda genom att vrida specifika amidbindningar under autolys och splitsning. Dessa proteiner, till skillnad från artificiellt syntetiserade modellföreningar, antas använda icke-kovalenta interaktioner för att vrida sina amidbindningar. Under många år, forskare vid University of Tokyo och Institute for Molecular Science har tillverkat molekylära burar som är självmonterade genom icke-kovalenta interaktioner. De använde sina molekylära burar för att begränsa amidmolekyler, som kan betraktas som analoger av små bitar av proteiner, och klämde amidbindningarna genom att trycksätta dem inuti sin bur.
Forskarna har rapporterat i denna artikel att amidbindningar, som har plana strukturer och är inerta i fritt utrymme, kan vridas, och amidföreningarna kan aktiveras genom att begränsa dem i deras molekylära bur (visas i figuren). När målamidföreningar och den molekylära buren blandas och värms upp i en vattenlösning, buren begränsar amidföreningarna. Enkristallröntgenstrukturanalys visade att två amidföreningar med vridna strukturer är inneslutna i buren. Vridningsvinkeln runt amidbindningarna visade sig nå 34 grader. Reaktionshastigheten för hydrolys av det vridna målet accelererades med en faktor fem. Forskarna lyckades skapa ett nytt artificiellt enzym av en tidigare oexploaterad mekanism som begränsar och vrider målmolekylerna för att aktivera en specifik kemisk bindning.
Forskarna lyckades också ändra reaktiviteten hos målmolekyler genom att begränsa "stoppningsmolekyler, "som inte är inblandade i reaktionen, tillsammans med målen i buren, därigenom exakt kontrollera graden av vridning av amidbindningarna. Utan fyllningsmolekylen, de två målamiderna är inneslutna i en bur. Ett av de två målen är vridet och det andra förblir plant. I kontrast, när konisk fyllning blandas och sedan blandas med målet i en bur, målet förblir plant. När en plan fyllningsmolekyl är involverad i målet, fyllningen ändrar formen på målet till en vriden struktur. Forskarna undersökte reaktionshastigheterna för hydrolys i de två fallen och fann att den plana fyllningen (tvinnat mål) accelererar hastigheten med 14 gånger, medan den koniska fyllningen (plana målet) accelererade hastigheten med tre gånger. Fyllningsmolekylerna gör det möjligt för forskarna att justera reaktionshastigheten exakt. Detta är en prestation utan motstycke som aldrig har hittats i tidigare studier. Denna forskning erbjuder en ny metod för aktivering av inerta molekyler och kan tillämpas på en mängd olika organiska reaktioner.
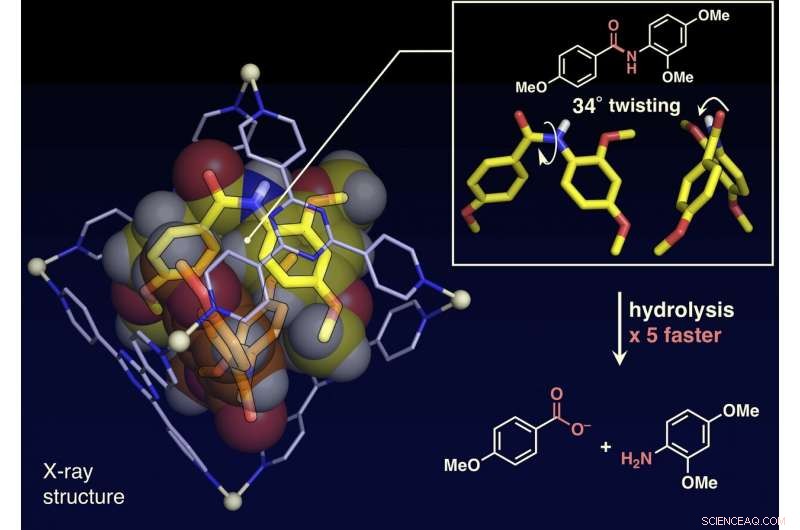
Enkristallstrukturanalysen visade att de plana amidmolekylerna var vridna upp till 34 grader inuti buren. Hydrolyshastigheten av en bas accelererades med en faktor fem. Kredit:NINS/IMS
Forskarna visade att amidmolekylerna kan aktiveras genom att vrida sig inne i buren utan krångliga kemiska modifieringsprocesser. "Vi letar efter en ny typ av bur som kan aktivera målen med högre effektivitet och applicera dem på andra kategorier av målmolekyler. Med våra nya burar, vi kommer att utveckla den nya aktiveringsmetoden för inerta molekyler. I framtiden, våra burar kommer att användas som katalysatorer, som selektivt pressar och aktiverar en specifik bindning av en målmolekyl och även som aktiveringsmedel för prodrugs som verkar i kroppen, sa Fujita.
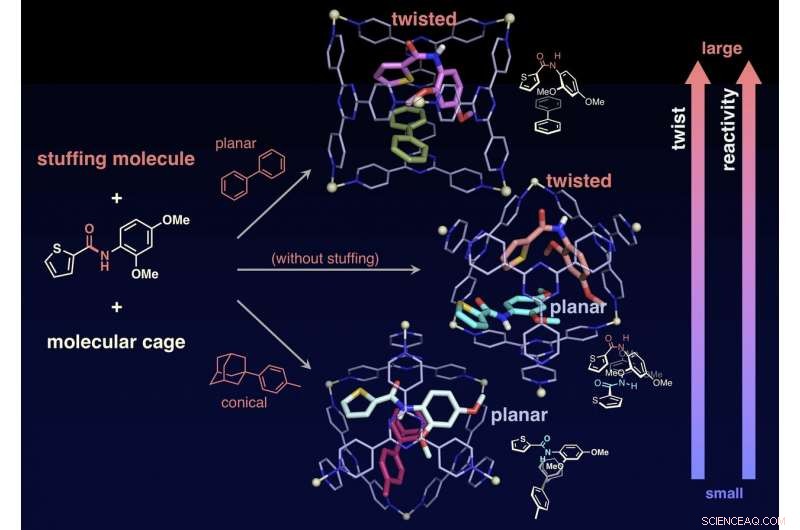
Vridningsvinkeln, och sedan reaktiviteten mot hydrolys, kan kontrolleras genom att stoppa instoppningsmolekylen tillsammans med målamiden i buren. Kredit:NINS/IMS