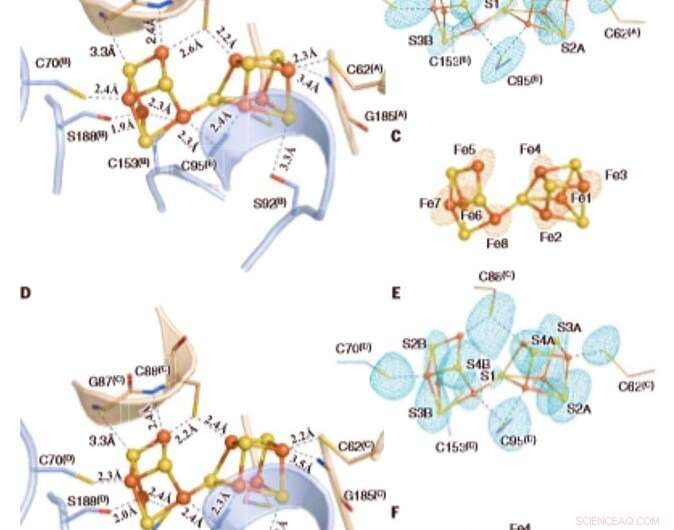
De oxiderade P-klustren i Av1*. Strukturer av P-kluster vid (A till C) gränssnittet mellan kedjorna A och B [P-kluster(A/B)] och (D till F) gränssnittet mellan kedjorna C och D [P-kluster(C/D) ] av Av1*. Kedjor A och C är a-subenheter, och kedjorna B och D är b-subenheterna av de två ab-dimererna av Avl*. [(A) och (D)] P-klustren visas i ball-and-stick-presentation, och nyckelresterna som interagerar med P-klustren indikeras som pinnar. Kedjor A och C visas som veteband, och kedjorna B och D visas som ljusblåa band. [(B) och (C)] P-kluster(A/B) och [(E) och (F)] P-kluster(C/D) överlagrade med [(B) och (E)] de anomala densitetskartorna beräknad vid 7100 eV vid en upplösning på 2,18 Å och kontur vid 4,0s, visar svavelatomernas position (myntblått nät); och med [(C) och (F)] de anomala densitetskartorna beräknade vid 7141 eV vid en upplösning på 2,1 Å och konturerade vid 15,0s, visar positionen för järnatomer (rött nät). Atomer är färgade enligt följande:Fe, orange; S, gul; O, röd; N, blå. Enbokstavsförkortningar för aminosyraresterna är följande:C, Cys; G, Gly; H, Hans; R, Arg; S, Ser. Kredit:Vetenskap, doi:10.1126/science.aaz6748
Enzymet nitrogenas är en biologisk katalysator som kan reducera dikväve (N2) till ammoniak i närvaro av en rad komplexa metallokofaktorer. Dock, de mekanistiska detaljerna i reaktionen förblir knappa. I en ny rapport om Vetenskap , Wonchull Kang och ett forskarlag i kemi, molekylärbiologi och biokemi vid University of California-Irvine, U.S., rapporterade en kristallstruktur på 1,83 ångström för nitrogenas molybden-järn (MoFe) protein, som de fångade under fysiologiska kväveomsättningsförhållanden. Resultaten av studien kan bedöma de möjliga mekanismerna för N 2 minskning och betydelsen av bältesvavelplatser under processen.
Nitrogenas är en katalysator för ett kritiskt steg i den globala kvävecykeln, under omgivningsreduktionen av atmosfäriskt kväve (N 2 ) till den biotillgängliga ammoniaken (NH 3 ). Molybdennitrogenasenzymet innehåller två proteinkomponenter:en som innehåller järn (Fe) proteinet i ett järnsvavel (Fe) 4 S 4 ) kluster med ett adenosintrifosfat (ATP)-bindningsställe inom varje subenhet. Den andra, molybdenjärn (MoFe) protein som innehåller ett α 2 β 2 heterotetramer med två komplexa metallkluster. Under molybden-nitrogenas (Mo-nitrogenas) katalys, den upprepade associationen och dissociationen mellan de två proteinkomponenterna möjliggjorde ATP-beroende elektronöverföring från Fe 4 S 4 kluster till MoFe-proteinet för substratreduktion. Nitrogenasets förmåga att transportera många elektroner till sin kofaktor gjorde enzymet mycket mångsidigt under substratreduktion.
Förstå verkningsmekanismen för nitrogenasenzymet
Många ansträngningar har gjorts för att förstå mekanismerna för nitrogenas sedan dess upptäckt, där vissa hade fokuserat på substrat- och inhibitorinteraktioner av enzymet. Av dessa ansträngningar, Kang et al. bestämt en strategi värd att överväga genom att begränsa överskott av elektrontillförsel som oavsiktligt drev N 2 reduktionsprocessen framåt. Detta återställde substratet eller mellanbundet tillstånd av enzymet till ett vilotillstånd eller reducerade enzymet till ett omärkligt blandat tillstånd. Processen var relevant eftersom nitrogenasproteiner rutinmässigt isoleras i närvaro av överskott av ditionit som ett externt tillfört reduktionsmedel, och avlägsnandet av denna artificiella elektronkälla i frånvaro av syre kan hjälpa forskare att fånga dikväve (N 2 ) eller dess mellanprodukter för analys.
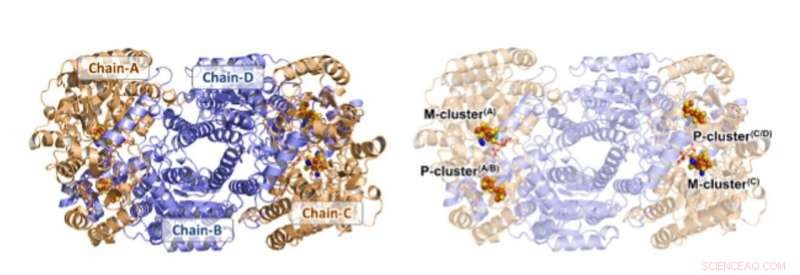
Struktur för Av1*. Solida (vänster) och transparenta (höger) bandpresentationer av heterotetrameren av Av1*, med a-underenheterna (kedja-A och kedja-C) och b-underenheter (kedja-B och kedja-D) färgade i vete och blått, respektive. M- och P-klustren illustreras som rymdfyllande modeller. Färgkod för atomer:Fe, orange; S, gul; O, röd; N, blå; Mo, cyan; C, grå. M-klustren i Chain-A och Chain-C betecknas M-kluster(A) och M-kluster(C), respektive. P-klustren vid gränssnitten Chain-A/Chain-B och Chain-C/Chain-D betecknas P-kluster(A/B) och P-kluster(C/D), respektive. PYMOL användes för att framställa denna figur. Kredit:Vetenskap, doi:10.1126/science.aaz6748
Som ett bevis på konceptet, Kang et al. framställde det råa extraktet av en anerob bakteriestam Azotobacter vinelandii med eller utan tillsats av ditionit efter cellavbrott. A. vinelandii-stammen uttryckte aktivt ett Mo-nitrogenas innehållande ett histidinmärkt MoFe-protein i båda fallen. När de analyserade aktiviteten hos dessa prover, de ditionitfria råextraktproverna var nästan inaktiva under substratreduktion - på grund av utarmning av elektroner i råextrakten under cellavbrott. Kang et al. kunde därför helt återställa aktiviteten hos prover genom att tillsätta ditionit och ATP (dvs genom att tillföra elektroner).
Kluster av nitrogenas – två unika metallkluster:P-klustret och M-klustret.
Baserat på de skisserade villkoren, när en nitrogenasuttryckande kultur som aktivt utför N 2 fixering utsätts för cellys utan ytterligare elektrontillförsel, nitrogenaset förblev funktionellt. Även om potentiellt stoppas i ett "vilande" eller mellanbundet tillstånd på grund av tillbakadragande av elektronflöde in i en järn-svavelmetallokluster känd som M-kluster, lokaliserad inom nitrogenasenzymet. När Kang et al. renade det ditionitfria råextraktet, det histidinmärkta MoFe-proteinet (betecknat som AV1* i studien) var aktivt under N 2 minskning och även fullt fungerande. När laget kristalliserade AV1*, de observerade bruna kristaller som böjde sig till en upplösning på 1,83 ångström (Å). De bekräftade den strukturella omarrangemanget av de två P-klustren av AV1* med användning av anomala densitetsdata och använde elektronparamagnetisk resonans för att observera den strukturella tilldelningen. Resultaten gav dem långsökta svar på den fysiologiska relevansen av detta experimentella tillstånd och pekade på ett begränsat flöde av elektroner mellan de två unika metallklustren (P- och M-kluster) av föreningen i frånvaro av ditionit.
En rimlig mekanism för N2-reduktion med Mo-nitrogenas. Kredit:Markus Ribbe och Yilin Hu, Vetenskap , doi:10.1126/science.aaz6748 
En rimlig verkningsmekanism som överensstämde med de experimentella observationerna inkluderade den stegvisa minskningen av dikväve (N 2 ) vid de tre svavelställena i bältet på nitrogenaskatalysatorn baserat på rotationen av M-klustret. Den föreslagna mekanismen börjar med tät bindning av N 2 på en specifik plats, följt av rotation av det bundna N 2 till en annan efterföljande plats (platser betecknade som S3A till S2B till S5A på föreningen). Under processen, reduktionen/protoneringen av N 2 till diazennivån skedde genom vätebindning, följt av ytterligare reduktion/protonering för dess omvandling till ammoniak, innan den frigörs från strukturen. Efterföljande rotation av klustret gav ett nytt N 2 molekyl till nästa plats för att initiera nästa omgång av stegvis N 2 minskning genom fortsatt klusterrotation i en delikat mekanism under katalys. Sådan cykling mellan olika reaktionsställen var löst analoga med mekanismen för ATP-syntasenzymet. Den roterande metallklustern möjliggjorde således effektivt multielektronreduktionen av N 2 genom en dela-och-härska-strategi.
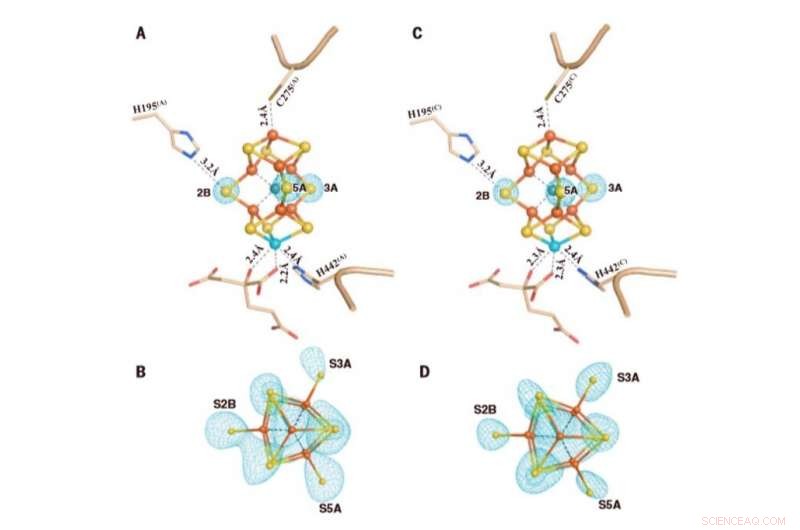
The M-clusters in Av1*(TOD). Structures of M-clusters in (A and B) chain A [M-cluster(A)] and (C and D) chain C [M-cluster(C)] refined at a resolution of 1.73 Å. Side view of (A) M-cluster(A) and (C) M-cluster(C) with key residues interacting with the clusters indicated as sticks. M-cluster(A) and M-cluster(C) are superimposed with the Fo-Fc omit maps of the belt sulfurs contoured at 13s (mint-blue mesh). View along the Fe1-C-Mo direction of (B) M-cluster(A) and (D) M-cluster(C) superimposed with the anomalous density maps calculated at 7100 eV at a resolution of 2.17 Å and contoured at 4.0s, showing the presence of the anomalous sulfur density (mint-blue mesh) at all belt sulfur positions (S2B, S3A, and S5A) in (B) M-cluster(A) and (D) M-cluster(C). Credit:Science, doi:10.1126/science.aaz6748
To understand the sulfur-displaced conformation of AV1* under limited electron flux, the team formed AV1* turnover with dithionite (designated as AV1*TOD), to yield brown crystals that diffracted to a resolution of 1.73 Å. The observations were consistent with the mechanism of bound dinitrogen species on the compound and illustrated the physiological relevance of the conformation during catalysis. The capacity to displace three different sites by a dinitrogen species was consistent with previous investigations on catalysis-dependent selenium. Kang et al. proposed many mechanisms to explain the observations, however they seek further experimental support to verify them. The team highlighted the possibility for all belt-sulfur sites to be involved in the process of catalysis due to the presence of asymmetric belt-sulfur displacements in the compound. The results aim to provoke a paradigm shift in the mechanistic thinking of nitrogenase activity, ultimately to understand the intricate mechanism of the enzyme.
© 2020 Science X Network