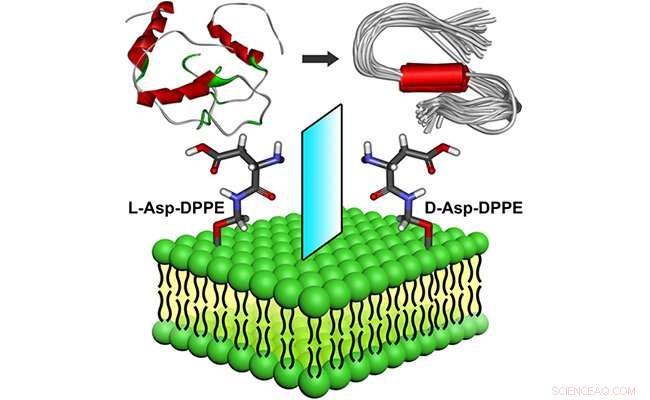
Molekylär kiralitet medierad amyloidbildning på fosfolipidytor. Kredit:WANG Xue
Alzheimers sjukdom (AD) är en av de största globala folkhälsoutmaningarna. Dock, patogenesen av AD är fortfarande oklar.
Ett antal studier visade att cellmembran spelar en avgörande roll i utvecklingen av AD, speciellt ackumulering av amyloid-β (Aβ). Därför är det viktigt att undersöka effekten av biologiska membran på amyloidbildning.
Nyligen, forskargrupper ledda av Prof. Qing Guangyan och Prof. Li Guohui från Dalian Institute of Chemical Physics vid den kinesiska vetenskapsakademin designade och förberedde ett par kirala aminosyramodifierade fosfolipider, visar anmärkningsvärt inflytande av molekylär kiralitet hos kirala liposomer på amyloidbildning.
Forskarna fann att de självmonterade L-liposomerna något hämmade Aβ(1-40) kärnbildningsprocessen men kunde inte påverka oligomerförlängningsprocessen. Som jämförelse, D-liposomerna inhiberade starkt både kärnbildnings- och förlängningsprocesserna för Ap(1-40).
Kirala liposomer hade inte bara god biokompatibilitet utan kunde också rädda Aβ(1-40)-aggregationinducerad cytotoxicitet med betydande kiral diskriminering, där cellviabiliteten var högre i närvaro av D-liposomer.
Under tiden, forskarna avslöjade bindningsstället, bindningssätt och drivkraft mellan Aβ(1-40) och kirala fosfolipidytor genom detaljerade simuleringar av molekyldynamik.
Dessa fynd utökade forskningen från artificiella kirala ytor till riktiga kirala fosfolipidytor, ger en djupare och verklig insikt för att förstå den avgörande amyloidosprocessen ur perspektivet av kiralt biogränssnitt.
Liposomer har övertygande biokompatibilitet, och konvergensen av liposomer med icke-naturliga D-aminosyror som amyloidhämmare är lovande i tidig förebyggande och behandling av AD, som pekar ut en tydlig riktning för utvecklingen av liposombaserade hämmare.
Studien publicerades i Kemivetenskap den 25 juni.