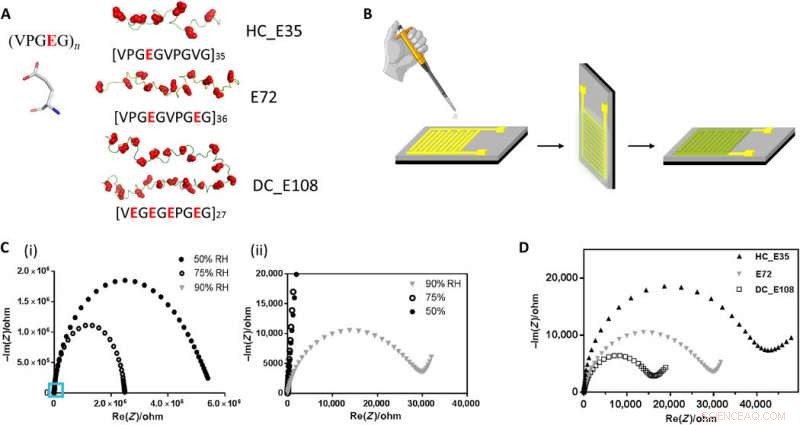
Struktur av anjonisk SUP, enheter för mätningar av protonledningsförmåga och prestanda för olika SUP:er i dessa enheter. (A) Primär struktur för SUP:er konstruerade med olika laddningstätheter. (B) Tillverkningsprotokoll för proteinfilmer deponerade på guld -IDE:er. (C) Impedansmätning av prov E72 i form av Nyquist-plot under olika RF. Siffran (ii) är inzoomningsområdet för (i) som indikeras av den blå fyrkanten. (D) Nyquist plot av proteintunna filmer från prover E72, HC_E35, och DC_E108 ekvilibrerad vid RH =90%. Den extrapolerade skärningen av den observerade halvcirkeln med x-axeln indikerar provmotståndet som skalas som HC_E35> E72> DC_E108. Upphovsman:Science Advances, doi:10.1126/sciadv.abc0810
Protoner är subatomära partiklar med en positiv elektrisk laddning. Protontranslokation spelar en viktig roll i naturfenomen och konstgjord teknik. Men det är fortfarande utmanande att kontrollera protonledning och tillverkning i biomaterial och enheter. I en ny rapport, Chao Ma och ett tvärvetenskapligt team av forskare i Kina, Nederländerna, och Tyskland, rationellt utformade protonledande proteinbeståndsdelar som översteg tidigare rapporterade proteinhaltiga (bestående av eller innehållande protein) system. De utvecklade strukturerna genom stegvis utforskning av peptidsekvenser från inneboende oordnade spolar till proteinöverladdade polypeptidchimärer. Det nya designparadigmet erbjuder potential för tillverkning av bioprotoniska enheter vid gränssnittet mellan artificiella och biologiska system, resultaten publiceras den Vetenskapliga framsteg .
Protonledning är ansvarig för grundläggande processer inom biologi, inklusive bioluminescens, syntesen av adenosin 5'-trifosfat (ATP) och ljusutlöst protontranslokation. Bioingenjörer och materialforskare hade tidigare utvecklat flera syntetiska material med protontranslokationsbeteende inklusive hybridsystem, även om deras brister har hindrat områdena bioelektronik och bioteknik. Att utveckla biomaterial dedikerade för protonledning, forskare måste utforska byggnadsställningar och sekvenser för deras inneboende protonledande beteende. Under hydratiserade tillstånd, protoner kan transporteras via vattenmolekyler längs ett intilliggande bindningsnät i en mekanism som kallas protonhoppning, som används som en ritning för att utforma protonledande strukturer de novo (dvs från grunden). I det här arbetet, Ma et al. utvecklades stegvis, proteinbaserat protonledande membran med en uppsättning ovikta, anjoniska överladdade polypeptider (SUP) som innehåller glutaminsyrarester.
Proteinfilmer på substrat och karakterisering via SEM och AFM. (A) Schematisk procedur för framställning av protonledande polypeptid- och proteinfilmer genom droppgjutningstekniken som används i denna studie. (B) Skanningselektronmikroskopi (SEM) bilder som visar den platta och homogena morfologin i vår anpassade tunna film (här visas E72 som ett exempel) på elektroderna. Den taggiga kanten på vänster sida av a) är den trunkeringsposition för tvärsnittsavbildning i b). (C) AFM-bild av en repad tunn filmyta (överst) och dess motsvarande höjdprofil (botten). Prov E72 visas här som ett exempel. Upphovsman:Science Advances, doi:10.1126/sciadv.abc0810 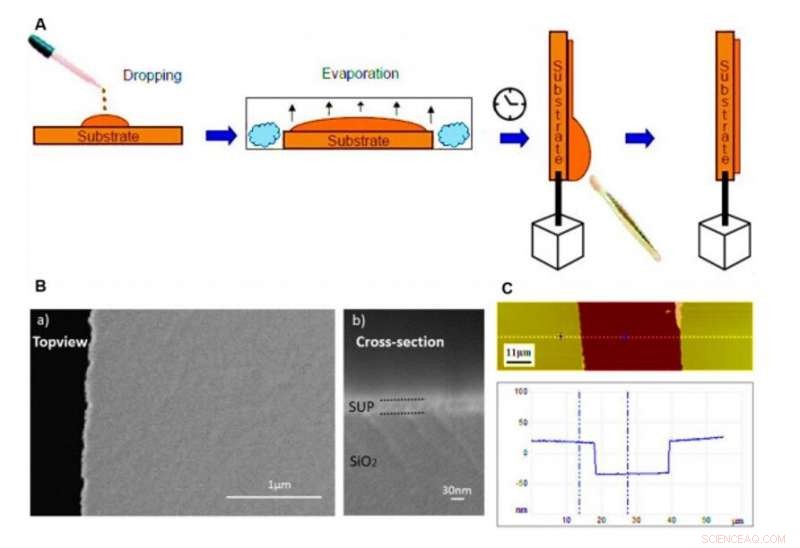
I polypeptidstommen i det protonledande membranet, de hydrofila (vattenälskande) laddade delarna tjänade som protonbärare. Teamet studerade protonledande prestanda hos dessa utfällda system för att erhålla fristående membran och fulländade den konstruktiva designen genom att slå samman silkesliknande ß-arkstrukturer med anjoniska SUP för att bilda självmonterade nanostrukturer. Teamet dekorerade ytorna med täta karboxylsyragrupper för hydratisering, protondissociation och bilda protonledningsvägar. Det mekaniskt stabila och fristående membranet överträffade hittills rapporterade transportegenskaper för proteinbaserade system för enastående protonkonduktivitet.
Teamet härledde de överladdade proteinerna från elastin; tidigare undersökt för tillämpningar av proteinteknik och gränssnittsmodifiering. De introducerade glutaminsyra (förkortat Glu eller E), som lätt kan deprotoneras under fysiologiska förhållanden till X -stället i proteinsekvensen, att bilda ostrukturerade negativt överladdade polypeptider (SUP-Es). Sedan konstruerade de tre olika varianter av överladdade polypeptider kända som E72, HC_E35 och DC_E108. Ma et al. använde elektrokemisk impedansspektroskopi (EIS) med guld interdigiterade elektroder (IDE) för att utvärdera tunnfilmsprotonledning och uppmätt protontransport som en funktion av relativ fuktighet. När luftfuktigheten ökade till 90 procent, protontranslokation förbättrades på grund av absorption av ett stort antal vattenmolekyler via karboxylsyra (-COOH) grupperna av materialet. Förutom relativ luftfuktighet, de undersökte också protonkonduktion i förhållande till laddningsbärartäthet för exemplar av intresse. Genom att justera laddningstätheten för de störda proteinerna, Ma et al. framgångsrikt kontrollerat protonkonduktansbeteende hos proteiner i filmer. På grund av den höga stabiliteten och enhetligheten hos de tunna filmerna av SUP, installationen visade inga tecken på defekter.
Överladdad −30GFP som består av en nanoskopisk β-fatveck för protonledning. (A) 3D-struktur av överladdad -30GFP med överskott av glutamin/asparaginsyror (i rött) på proteinytan. Den vänstra tecknade bilden visualiserar strukturen i ytläge, visar positiva rester i blått och negativa i rött. Den högra tecknen visualiserar −30GFP som ett banddiagram som uteslutande visar negativa laddningar. (B) Impedansmätning av prov -30GFP (gulaktiga fasta prickar) i Nyquist -plottning vid 90% RF, jämfört med andra SUP -prover. (C) Jämförelse av konduktans mellan prover E72, HC_E35, DC_E108, och -30GFP (**P =0,004, n> 3). (D) GIXD-mönster för strukturundersökning av de olika filmerna. Två distinkta signaler observerades för den nanostrukturerade −30GFP (vänster), medan ingen signal upptäcktes för E72-filmer (höger), anger dess ostrukturerade karaktär. Upphovsman:Science Advances, doi:10.1126/sciadv.abc0810 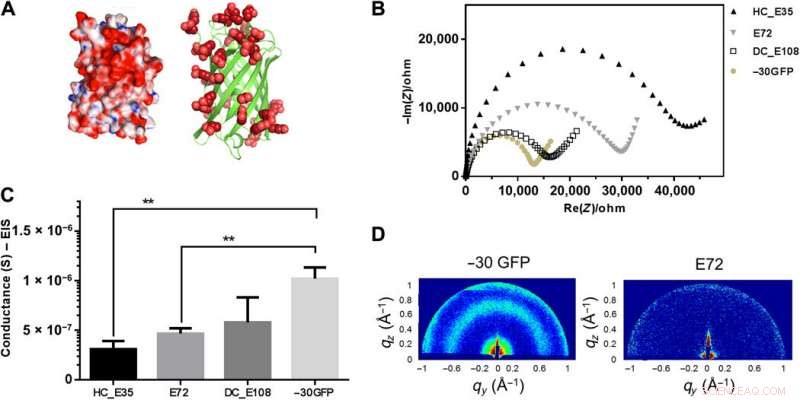
Ma et al. studerade sedan vidare vikta nanosiserade proteinskelett och utrustade de nanoskala ställningarna med karboxylsyra på ytan - liknande SUP. Med röntgendiffraktion, de undersökte strukturell information inuti de överladdade proteinproverna för att få distinkta signaturer av deras strukturella domäner, att visa hur nanostrukturerade komponenter skulle kunna underlätta protontranslokation. Arbetet gjorde det möjligt för teamet att rationellt konstruera proteinmotiv för att utföra protonledning. Motiverad av ökad protonledningsförmåga, Ma et al. kombinerade de resulterande designelementen med de befintliga superladdade polypeptidstrukturerna (SUP).
Istället för att använda β-fatmotiv i materialarkitekturen, they used the mechanically stable β-sheet structures—a sequence obtained from spider silk. They named the combined system of anionic SUP with β-sheet sequences as 'spider-E'. The scientists produced the recombinant anionic spider-E material using plasmid-vector expression systems in the lab and determined the structure using X-ray diffraction, Fourier transform infrared (FTIR) spectroscopy and atomic force microscopy. The spider-E film showed higher proton conductance compared to amorphous SUP films alone.
Sequence, structure, and proton conduction of recombinant supercharged spider-E thin films on IDE. (A) Rationally designed supercharged spider silk–inspired proteins (spider-E). The spider motif contains a poly-A sequence (green) and anionic supercharged regions (red) that are forming the loops between the rigid β sheets. (B) Structure analyses of the spider-E supported film. Two peaks were detected by GIXD, indicating the characteristic intersheet and interstrand distances, respektive. (C) FTIR characterization of the films indicate random coils for the E72 sample (gray dashed line) with an amide I peak located at 1640 cm−1 and a shift to a typical β sheet amide I peak for the spider-E sample (red solid line) at 1620 cm−1. (D) Morphology analyses of the spider-E supported film. Quantification of the nanostructures assembled through spider β sheet domains by AFM. This sample was obtained by extensive swelling of the film by water contact to induce separation between the domains. (E) Nyquist plots obtained at RH =90% for the five genetically engineered samples including spider-E. The impedance curve of the spider-E sample shows the lower resistance value among all the samples (red). (F) Comparison of conductance of the resulting devices demonstrating the stepwise increase in the transport properties due to the improved protein design. The proton transport of spider-E thin films on IDEs is noticeably higher than HC_E35 (***P =0.0009, n> 3) and DC_E108 (*P =0.0155, n> 3). Upphovsman:Science Advances, doi:10.1126/sciadv.abc0810 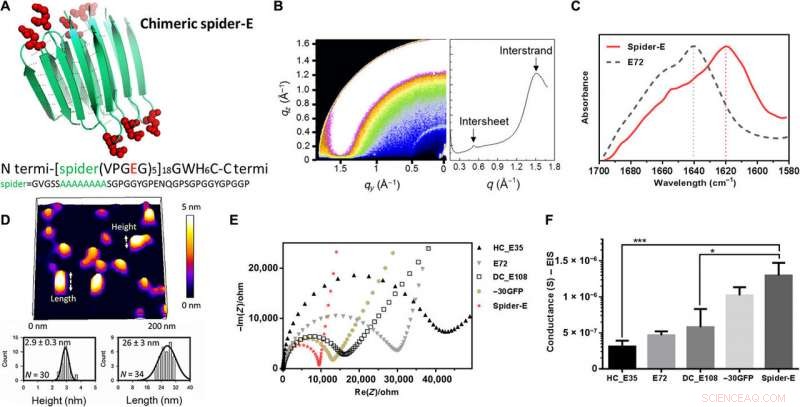
The β-sheet structured material system showed improved mechanical properties as a free-standing membrane that could be easily produced. Till exempel, Ma et al. drop casted the spider-E solution to engineer a transparent macroscopic membrane in the lab. The results showed mechanical robustness of the construct due to the inclusion of spider motifs with a yield strength comparable to recombinant spider silk materials. The researchers showed how spider motifs formed β-sheet structured domains with hydrophilic surfaces composed of glutamic acid-rich SUP strands, to facilitate excellent proton hopping. The study pushed the limits of existing proteinaceous proton-conducting materials to represent a key example of protein engineering. The work represents one of the first examples that combines protein engineering and the rational design of bulk architecture with collective properties from molecular ensembles.
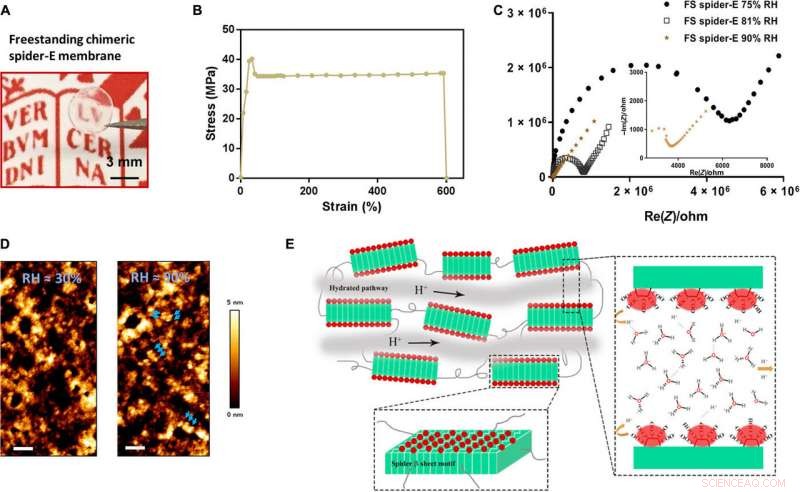
Bulk freestanding chimeric spider-E membrane with extraordinary proton transfer properties. (A) A digital photograph illustrates the dimensions and transparency of the membrane. The protein membrane is clamped with a fine tweezer. Photo credit:Chao Ma, University of Groningen. (B) Mechanical characterization of the freestanding (FS) protein membrane, showing a typical tensile stretching curve. (C) Nyquist plot illustrating the conductance behavior of the FS spider-E membrane under different RHs. The film shows best proton translocation properties at 90% RH. (D) AFM characterization of the FS spider-E membrane under ~30 and ~90% RH conditions. Scale bars, 100 nm. Blue arrows point at distinguishable nanostructures. (E) Proposed mechanism of proton transport in the spider-E membrane at RH =90%. The protons hop between water molecules nanoconfined in the hydrated network of nanodomains formed by spider β sheet motifs (in green). The glutamic acid residues in the chimeric nanostructures present carboxylic groups (in red) on the surface, providing the protons and coordinating water molecules. Upphovsman:Science Advances, doi:10.1126/sciadv.abc0810
På det här sättet, Chao Ma and colleagues applied rational molecular de novo design and engineering to achieve a bioinspired protein-derived bulk material with robust properties of proton conduction and excellent mechanical stability. They tested the surface modifications using a range of biophysical tools. The team developed the new generation, bioinspired bulk material and explored successive sequence designs to offer a promising platform for applications in biotechnology and envision the use of such materials for proton transport in miniaturized biofuel cells of the future.
© 2020 Science X Network