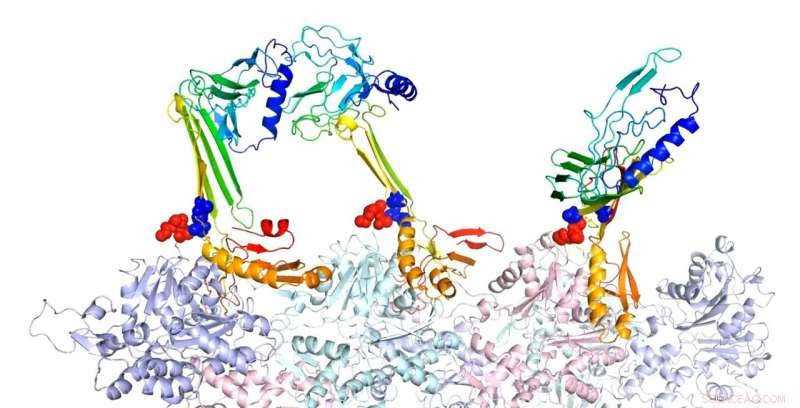
Forskare vid Rice University modellerade bindningsstrukturerna för aktin och associerade proteiner som de tror är ansvariga för bildandet av långtidsminne. Här, beta-hårnålsformen av blixtlåssekvens är en potentiell kärna för bildandet av intramolekylära beta-ark. I den förutsagda komplexa strukturen av F-aktin och tre PRD+ABD-konstruktioner som visas ovan, de tre PDB+ABD-konstruktionerna visas i regnbågsfärg, från blått till rött, från N-terminal till C-terminal. Ytorna på de första 4 negativa resterna av aktinmonomerer är färgade i rött och ytorna på de två positiva ändarna av blixtlåssekvensen är färgade i blått. Kredit:Centrum för teoretisk biologisk fysik/Rice University
Ett kameleontliknande protein i neuroner kan ändra sig, och i processen förändra våra hjärnor.
Forskare vid Rice University och University of Texas Health Science Center i Houston (UTHealth) upptäckte nya ledtrådar i proteinet CPEB3 som en del av deras envisa strävan efter mekanismen som tillåter människor att ha långtidsminnen.
Studien av Rice teoretiska biofysiker Peter Wolynes och Neal Waxham, en neurobiolog vid UTHealths McGovern Medical School, ger insikt i en positiv återkopplingsslinga mellan bildandet av aktinryggraden som ger dendritiska ryggraden deras form och flexibilitet och de aktinbindande domänerna i CPEB3, en funktionell prion som binder RNA som också bildar långlivade aggregat som verkligen kan lagra de saker som minnen är gjorda av.
Proteinvikningsmodeller av Wolynes och hans grupp vid Rice's Center for Theoretical Biological Physics (CTBP) och experiment vid UTHealth visade tidigare okända strukturella detaljer för CPEB3 och hur det binder till aktin, som rapporterats i Proceedings of the National Academy of Sciences papper.
I processen, de undersökte också nyckelrollen som spelas av ett protein som kallas SUMO, en regulator som fäster till och lösgörs från andra proteiner i celler för att modifiera deras funktioner. Forskarna misstänker att det hjälper till att reglera när och hur CPEB3s kameleontliknande ändar (N-terminalen och C-terminalen) binder till antingen SUMO eller den flexibla, filamentös aktin (f-aktin) ryggar i dendritiska spikar.
CPEB3-proteiner är lösliga när de är kopplade till SUMO, som också begraver deras aktinbindande platser. Men under synaptisk aktivitet, de kan "deSUMOyleras" och bli tillgängliga för att binda med de hydrofoba bindningsfickorna längs f-aktinfilament.
Modellerna visar att när de attraheras av aktin, CPEB3 övergår från en lindad spiral av spiraler till en beta-arkstruktur som "blixtar" till en hårnålskonfiguration som gör att den kan aggregeras med andra CPEB3-proteiner.
Vid aggregering, CPEB3 verkar översätta sina målbudbärar-RNA, som inkluderar aktin-mRNA som stärker de synaptiska förbindelserna som är viktiga för minnet, slutföra den positiva slingan.
"Detta är ett mer ambitiöst projekt än aktin-CaM kinasstudien, där vi också simulerade ett riktigt stort aktinsystem med ett riktigt stort protein, " sa Wolynes. I den studien, publicerades för ett år sedan, CTBP-forskare modellerade hur ett centralt protein (CaMKII) håller ihop parallella aktinfilament, ett tillstånd som kunde visualiseras i ett elektronmikroskop av Waxhams labb.
Nu definierar forskarna de strukturella detaljerna som gör att CPEB3 kan binda till antingen aktin eller SUMO, men inte båda. "En av de viktigaste aspekterna av detta dokument är att förena de två helt olika delarna av historien, " sade han. "Vi tror att CPEB-terminalerna är kameleonlika eftersom de låter molekylen välja om den kommer att interagera med SUMO:en eller med aktinet.
"Vi är inte till slutet av historien ännu, " Sa Wolynes. "Men de senaste resultaten placerade oss på en rimlig plats att säga mer om mekanismen."