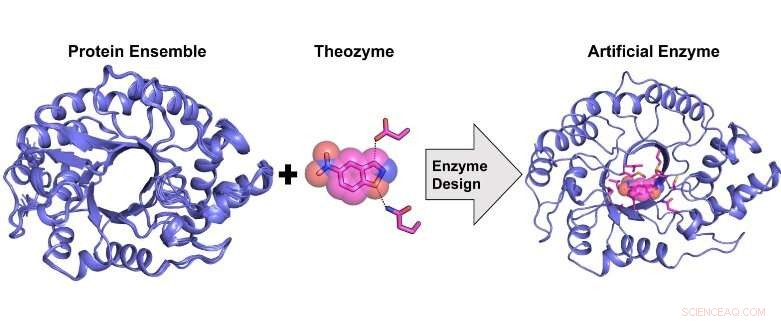
Beräkningsdesign av ett mycket aktivt artificiellt enzym från en proteinstrukturell ensemble. Kredit:Rojo Rakotoharisoa
En grupp forskare vid University of Ottawa har letat efter sätt att förbättra enzymdesignmetoder och publicerade nyligen sina resultat i Naturkommunikation .
Enzymer används i många industriella och biotekniska tillämpningar. Med sina många fördelaktiga egenskaper, de är de mest effektiva katalysatorerna som är kända – de har till och med kraften att påskynda kemiska reaktioner med mer än en miljard gånger. Men eftersom antalet naturligt förekommande enzymaktiviteter är begränsat, antalet ansökningar är också begränsat. Medan forskare har lyckats skapa konstgjorda enzymer, deras katalytiska effektivitet når inte samma nivå som naturliga enzymer.
Vi pratade med seniorförfattaren Roberto Chica, Hel professor vid institutionen för kemi och biomolekylära vetenskaper vid University of Ottawa, för att lära sig mer om hans fynd.
Kan du berätta mer om artificiellt utformade enzymer?
"Under de senaste 20 åren, forskare har framgångsrikt designat artificiella enzymer från grunden för en mängd olika organiska transformationer. Detta gjordes med hjälp av en procedur som kallas "beräkningsenzymdesign" där ett katalytiskt ställe byggdes beräkningsmässigt på en redan existerande proteinställning som saknar den katalytiska målaktiviteten.
Även om det är framgångsrikt, detta tillvägagångssätt har uteslutande gett artificiella enzymer som uppvisar katalytisk effektivitet som är storleksordningar lägre än de för naturliga enzymer, kräver efterföljande optimering med vad som kallas "riktad evolution" för att förbättra aktiviteten. Riktad evolution är en process där slumpmässiga mutationer introduceras i ett protein för att generera ett stort bibliotek av mutanta enzymer, som sedan screenas för att identifiera fördelaktiga mutationer. Det kräver ofta flera omgångar av slumpmässig mutagenes och screening för att öka aktiviteten avsevärt."
Hur relaterar din forskning till riktad evolution?
"I vårt arbete, vi avslöjar hur riktad evolution förbättrar den katalytiska effektiviteten hos en beräkningsmässigt utformad biokatalysator med ungefär 1000 gånger genom att justera ensemblen av strukturella undertillstånd som enzymet kan prova för att gynna de som är katalytiskt kompetenta.
Baserat på dessa observationer, vi konstruerar en artificiell biokatalysator med en katalytisk effektivitet i nivå med det genomsnittliga naturliga enzymet."
Vad är den effektfulla upptäckten?
"Vi utvecklade en ny beräkningsmetod för enzymdesign som är mer exakt än tidigare metoder eftersom den gör det möjligt att approximera den inneboende flexibiliteten hos proteinställningen som används som mall för design."
Varför är detta viktigt?
"Detta är viktigt eftersom tidigare metoder fokuserade på att skapa en stabil struktur som ignorerar den inneboende dynamiken i naturliga enzymer, vilket är avgörande för deras funktion (dvs enzymer måste "röra" sig för att vara effektiva katalysatorer).
Tidigare, det var inte känt om ett artificiellt enzym som uppvisar en katalytisk effektivitet i paritet med den hos ett naturligt enzym kunde utformas beräkningsmässigt. Vi visar att detta är möjligt men bara genom att använda en strukturell ensemble av proteinmallar som approximerar konformationell flexibilitet istället för en enda mall som tidigare gjorts.
Resultaten som presenteras i vårt manuskript tyder på att beräkningsenzymdesign med hjälp av en strukturell ensemble kan förhindra behovet av riktad evolution genom att tillåta katalytiskt kompetenta undertillstånd att provtas under designproceduren."
Vilka är de potentiella tillämpningarna av din forskning?
"Om vi kunde designa, från början, enzymer som kan katalysera alla målkemiska reaktioner med hög effektivitet, det skulle öppna dörren till mycket värdefull bioteknik som för närvarande är otillgänglig med naturliga enzymer."
Finns det något du vill lägga till?
Ja, forskning pågick från 2018 till 2020, vid University of Ottawa och University of California, San Francisco.
Uppsatsen "Ensemble-baserad enzymdesign kan recapitulate the effects of laboratory directed evolution in silico" publicerades nyligen i Naturkommunikation .