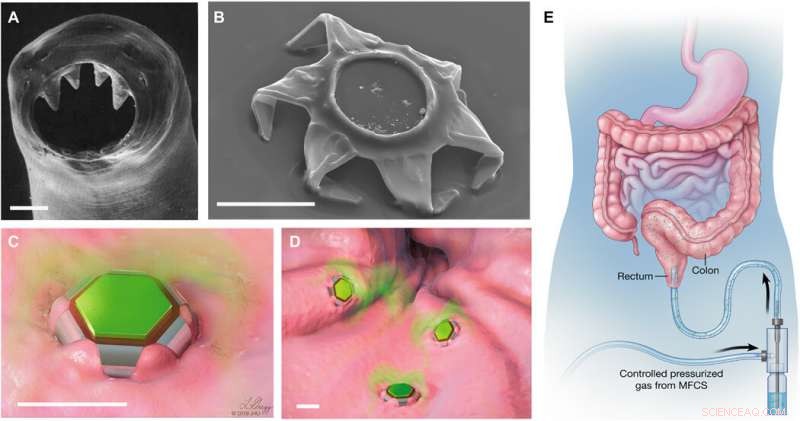
Formförändrande behandlare som självlåsande läkemedelsleveransanordningar. (A) avbildning av elektronmikroskopi (SEM) av ventrikeltänderna hos krokmask A. duodenale. Masken använder dessa vassa tänder för att tränga igenom slemhinnan och fastnar i mag -tarmkanalen i upp till 2 år. Omtryckt från Human Parasitology, 4:e utg. Upphovsrätt 2013, med tillstånd från Elsevier. (B) SEM -bild av en theragripper i den slutna konfigurationen. Som krokmask, theragrippers är utrustade med skarpa mikrotips. Schematiska illustrationer av (C) en enda och (D) många teragripare fästa vid slemhinnevävnaden och släppa inkapslat läkemedel (färgat i grönt). Skalstänger, 100 μm (A till D). (E) Konceptuell illustration av rektal administrering av läkemedelsbelastade theragrippers med användning av en tryckaktiverad mikrofluidisk flödesregulator. Bilder (C) till (E) illustrerades av L. Gregg. MFCS, mikrofluidiskt flödeskontrollsystem. Upphovsman:Science Advances, doi:10.1126/sciadv.abb4133
Omslagets berättelse online Vetenskapliga framsteg denna vecka innehåller en konceptuell gastrointestinal (GI) mikroenhet, utvecklat av ett forskargrupp för förlängd läkemedelsfrisättning. Läkemedelsleveransplattformar för förlängd läkemedelsfrisättning har visat sig vara utmanande att utveckla inom bioingenjör på grund av gastrointestinala (GI) rörelser i rörelsen och deras resulterande eliminering från kroppen. I en ny rapport, Arijit Ghosh och ett team av tvärvetenskapliga forskare inom kemisk och biomolekylär teknik, gastroenterologi och hepatologi, materialvetenskap, läkemedelsupptäckt och neurologi vid Johns Hopkins University i USA rapporterade om nya läkemedelsladdade enheter som är bioinspirerade av greppmekanismerna för parasitiska rundmaskar som kallas krokmaskar. Parasiterna kan dröja kvar i tunntarmen under långa tidsramar som matar på värdens blod.
Ghosh et al. designat och utvecklat en gripande konstruktion som de kallade theragrippers för att gräva sina klor i slemhinnan i tarmkanalen. Enheterna utförde gripande som svar på kroppsvärme eller andra biologiska signaler och släppte ut läkemedel i GI -lumen. Som bevis på konceptet, de visade hur anordningarna fastnade för GI-områden hos levande råttor i 24 timmar och visade en sexfaldig ökning av eliminationshalveringstiden för ett icke-steroidalt antiinflammatoriskt läkemedel som används för att lindra måttlig smärta. Arbetet visade att enheten hjälpte läkemedlet att stanna kvar i kroppen under en betydligt längre tid. Arbetet ger förstklassiga bevis på självlåsande mikroenheter för att effektivt förbättra långvarig och förbättrad läkemedelsleverans.
Levererar läkemedel i mag -tarmkanalen
I det här arbetet, Ghosh et al. inspirerades av biomekanismen hos Ancylostoma duodenale (krokmaskar) som finns i tarmarna i upp till två år. Arbetet presenterade det första prekliniska beviset på låsmekanismer i submillimeterskala för förbättrad frisättning och retention av läkemedel in vivo. Läkemedelsadministration genom mag -tarmkanalen kan förbättra följsamheten jämfört med injicerbara, vilket resulterar i bättre behandling. Läkemedel som administreras genom mag -tarmkanalen möjliggör effektiv absorption och systemisk cirkulation på grund av den enorma tarmytan och den rika vaskulariseringen av mag -tarmslemhinnan. Till exempel, forskare hade tidigare utvecklat slemgenomträngande partiklar (MPP) för förbättrad retention, även om sådana anordningar avlägsnades efter en dag på grund av clearance av det underliggande slemskiktet. Det finns därför för närvarande ett akut behov av att utveckla utökade läkemedelsleveranssystem.
Schematisk framställning av krokmaskinspirerade mikroenheter som förbättrade förlängt läkemedelSkematisk framställning av krokmaskinspirerade mikroenheter som förbättrade utökad läkemedelsleverans hos råttor. Bildkredit:Lydia Gregg 2020 JHU, Vetenskapliga framsteg, doi:10.1126/sciadv.abb4133 leverans hos råttor. Bildkredit:Lydia Gregg 2020 JHU, Vetenskapliga framsteg, doi:10.1126/sciadv.abb4133
Experimentet:Utveckla theragrippers
För att åstadkomma automatisk låsning i GI -lumen, Ghosh et al. förlitade sig på den termiskt utlösta frigöringen av enheten. De spärrade in en läkemedelsbelastning på mikroaktuatorerna för att leverera ketorolac (en smärtstillande) som ett modellläkemedel. Theragripparna hölls kvar i tjocktarmen i 24 timmar, möjliggör betydande exponering för läkemedlet, vilket resulterar i en 10 gånger högre plasmaketorolakoncentration 12 timmar efter administrering. Proof-of-concept-arbetet validerade det aktiva, formförändrande och självlåsande teragripare för förlängd läkemedelsfrisättning i mag-tarmkanalen. Forskarna använde flera skarpa mikrotips för att designa teragripparna som säkerställer att de fastnar på GI -slemhinnan ungefär som krokmaskar. De täckte det tjocka, styva segment och dubbelskiktade gångjärn av teragripparna med ett värmekänsligt vaxlager. Ytparaffinet eller vaxlagret på enheten mjuknade vid kroppstemperatur efter implantation för att autonomt utlösa klorna inuti GI -kanalen hos djurmodellen.
Teamet använde hybridmaterial som innehöll en metallpolymer gjord av guld och krom och bar en läkemedelseluerande polymerlapp för kontrollerad frisättning av läkemedel. Vidhäftningsstyrkan hos den läkemedelsbelastade polymeren till den underliggande metallställningen förhindrade delaminering (avlägsnande) av läkemedelsplåstret under GI-peristaltik. Materialen var biokompatibla utan potentiell toxicitet för läkemedelsleverans. Teamet valde den rektala vägen för enhetsadministration som är vanligast för barn och vid terapeutiska ingrepp för ulcerös kolit.
Fluorescein möjliggjorde visualisering av kemisk frisättning från theragrippers. Upphovsman:Science Advances, doi:10.1126/sciadv.abb4133 
Ghosh et al. först avstämde porositeten hos läkemedelsplåstret som elektrodeponerades på enheten för att ladda och släppa ut läkemedel i 24 timmar. De använde ketorolac, godkänt av U.S. Food and Drug Administration, icke-steroida, antiinflammatoriskt läkemedel som en modellkandidat med en hög clearanceprofil (halveringstid på mindre än 3 timmar) för in vivo-experiment i en gnagarmodell. Polymerens porstorlek underlättade frisättningen av betydande mängder ketorolak med en acceptabel hastighet, och laget använde 250 µm stora teragripprar för in vivo läkemedelsleverans hos råttor. Konstruktionerna var 32 gånger mindre än den typiska tjockleksdiametern hos råttor och vägde cirka 300 g. Ghosh et al. stämde avtryckarpenetrationen genom att variera konstruktionens parametrar, och använde finite element -metoden för att uppskatta kraften som alstras av anordningens vikklor. Teamet använde en begränsning vid spetsen av theragrippern för att förhindra att den viker sig under simuleringarna och beräknade det ungefärliga trycket för varje theragripper -mikrotip på tjocktarmen - som låg i intervallet 0,4 till 0,6 MPa. Resultaten indikerade deras potential att utöva tillräckligt tryck för att bryta slemhinnebarriären utan att skada tjocktarmen.
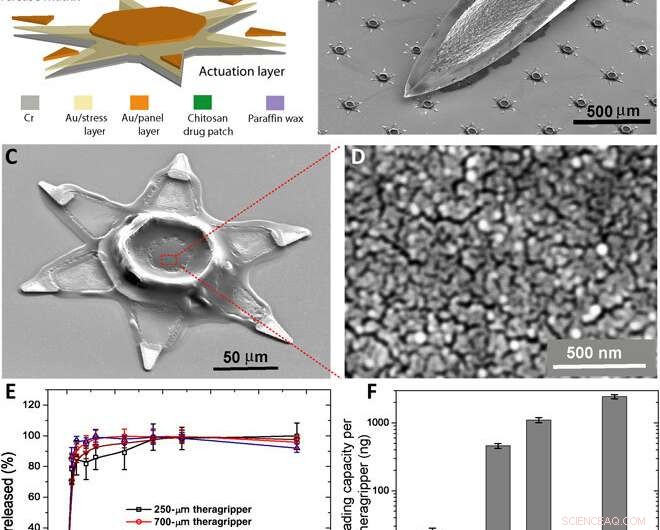
Parallell tillverkning av theragrippers och deras in vitro läkemedelsladdnings- och frisättningskarakteristika. (A) Funktionellt blockdiagram som illustrerar mikrofabrikationsstegen för en rad theragrippers, visar aktiveringsskiktet, läkemedelseluerande lager, och den termoresponsiva utlösaren. (B) SEM-bild som visar theragrippers bredvid spetsen av en 22-gauge injektionsnål. Theragripparna är tillräckligt små för att passera säkert genom mag -tarmkanalen utan att orsaka magstopp. (C) SEM -bild som visar en enda 250 μm, as fabricated theragripper with the drug-encapsulated chitosan patch at the center and the paraffin wax trigger layer on the hinges. (D) High-resolution SEM image showing the surface morphology of the chitosan patch at the center of the theragripper. The patch has pores less than 100 nm in size. (E) Release characteristics of ketorolac (KT) from theragrippers of four different sizes. (F) Plot showing the relative scaling of the drug loading capacity of theragrippers of different sizes. The entire loaded drug gets released over a period of 24 hours. While the 250-μm theragrippers were used for our in vivo experiments in rats, larger 1.5-mm theragrippers can be loaded with about 100 times more drug, for use in larger animal models and humans. Upphovsman:Science Advances, doi:10.1126/sciadv.abb4133
Ex vivo and in vivo attachment followed by systemic drug delivery
The team performed ex vivo (experiments on tissue conducted externally in a laboratory) theragripper attachment studies using rat colon tissue and visualized surface penetration using scanning electron microscopy (SEM). During in vivo experiments in rats, Ghosh et al. deployed thousands of grippers in a single shot by using a pneumatic microfluidic controller (PMC). The team delivered the drug deploying theragrippers intrarectally via a pneumatic delivery system to jugular vein cannulated rats. The rat colon appeared normal at the sites of attachment, indicating the absence of tissue damage or inflammation. The team also conducted similar experiments with a porcine (pig) model to understand theragrippers as a resident device in the upper GI tract. During these investigations, the device transited through the esophagus in less than a minute and remained attached to the colon for up to a day. All experiments demonstrated the safe elimination of the grippers from the body through natural mucosal turnover. Each theragripper contained approximately 23 nanograms of ketorolac for sustained drug concentrations and showed delayed clearance compared with pristine ketorolac.
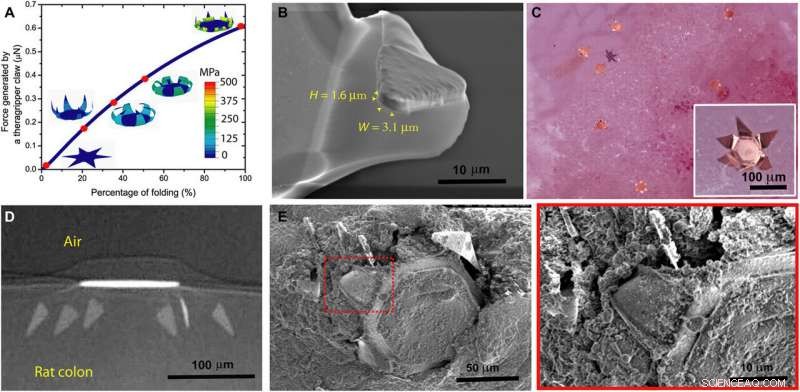
Theragrippers can apply sufficient force to penetrate the mucosa. (A) Plot of the force generated by a theragripper as a function of the percentage of folding, generated by FEM. Each claw of the theragripper can generate a maximum force of around 0.6 μN per hinge. Insets show the simulated configurations at different stages of the folding process marked by red dots. The colors in the legend indicate the magnitude of the von Mises stress in the gripper. (B) Close-up SEM image of the tip of a theragripper, showing the cross section of the tip having a width (W) of approximately 3.1 μm and a height (H) of 1.6 μm. To estimate the pressure exerted by this tip as the gripper actuates, we used the Hertz contact mechanics model and assumed the tip to be a sphere of diameter 1.6 to 3.1 μm. (C) Ex vivo experiment showing many theragrippers latching onto the colon of a rat. The inset shows the bright-field zoomed-in image of a single theragripper. (D) μ-CT image of the cross section of a theragripper penetrating into the colon ex vivo. (E) SEM image of a theragripper latching onto the colon mucosa ex vivo. (F) Zoomed-in image of the red outlined region in (E), showing the penetration of the claw into the colon tissue. Upphovsman:Science Advances, doi:10.1126/sciadv.abb4133
På det här sättet, Arijit Ghosh and colleagues developed a versatile platform of thermoresponsive theragrippers for drug dispersion in smaller conduits within the body. The team markedly improved the performance by altering the geometry, hydrogel matrix and drug formulation to observe drug release and the retention of grippers in the colon for 24 hours. Due to the thermoresponsive nature of theragrippers, the team will need to refrigerate the devices for immediate and long-term storage. They conducted proof-of-concept studies with the model drug ketorolac, which showed an increased half-life of almost 12 hours, the concept can be extended to other drugs. The new and versatile theragripper drug delivery system is based on self-latching in live animals and presents a new paradigm in drug administration.
© 2020 Science X Network