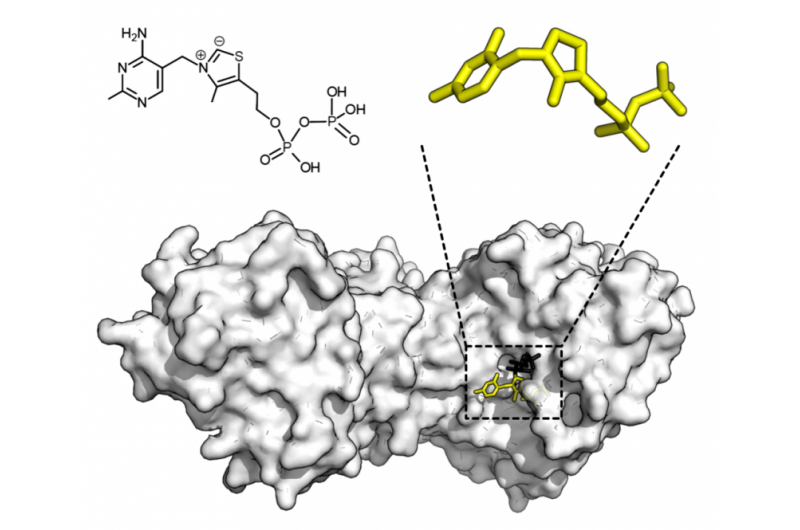
Kemisk struktur för tiaminpyrofosfat och proteinstruktur för transketolas. Tiaminpyrofosfatkofaktor i gult och xylulos 5-fosfatsubstrat i svart. Kredit:Thomas Shafee/Wikipedia
Forskare har brutit mot reglerna för enzymteknik för att låsa upp en ny metod för att skapa kemiska reaktioner som kan låsa upp ett brett utbud av nya tillämpningar – från att skapa nya läkemedel till livsmedelsproduktion.
I deras tidning publicerad idag i Naturkatalys , Professor Francesca Paradisi och Dr Martina Contente från University of Nottingham och University of Bern visar en ny metod för att producera kemiska molekyler mer effektivt genom en ny enstegsreaktion i enzymet.
Professor Paradis är professor i biokatalys vid School of Chemistry i Nottingham och professor i farmaceutisk kemi vid University of Bern, hon förklarar:"Vi har visat hur en mycket enkel mutation i en av nyckelresterna av ett användbart enzym dramatiskt har utökat dess syntetiska omfattning, möjliggör användningen av mutantvarianten vid framställningen av utmanande kemiska molekyler, såväl som naturliga metaboliter som är avgörande i många biologiska processer i kroppen."
Varje lärobok om enzymer kommer att rapportera om hur de katalytiska aminosyrorna i en given enzymfamilj är mycket konserverade, de är i själva verket en signatur för den typ av kemi ett enzym kan göra. Variationer förekommer och i vissa fall, om den ersättande aminosyran är liknande, båda kan hittas i betydande andel i naturen, men andra kan vara mycket mindre vanliga och finns endast i ett begränsat antal arter.
"I den här studien har vi utforskat ett orört område av enzymteknik och modifierat en nyckelkatalytisk rest i det aktiva stället för ett enzym, ", tillägger professor Paradisi. "Tidigare trodde man att detta skulle orsaka en förlust av aktiviteten hos enzymet men vi har funnit att detta inte är fallet när denna biokatalysator används i en syntetisk riktning och i själva verket kan utmanande men mycket användbara molekyler nu tillverkas under milda förhållanden som lätt kan skalas upp och kopieras kommersiellt för användning i ett brett spektrum av produkter."
För att ändra substratomfånget för ett enzym har tillvägagångssättet i allmänhet varit att mutera resterna som är involverade i substratigenkänning, antingen genom rationell design eller riktad evolution, lämnar alltid orörda de katalytiska.
Den muterade varianten av ett acyltransferasenzym skapades snabbt och medan den naturliga biokatalysatorn skulle fungera med alkoholer och linjära aminer, mutanten arbetar med tioler och mycket mer komplexa aminer också. Forskningen visade att den nya varianten verkligen har förlorat förmågan att hydrolysera estrar, men för syntetiska applikationer, där en ester eller andra funktionella grupper måste tillverkas (tioestrar och amider) och inte klyvas, detta är faktiskt en stor fördel.
Dr. Martina Contente tillägger, "Vi har fått fantastisk feedback på den här studien från forskarvärlden eftersom den ger ett nytt verktyg för kemi som kan tillämpas på ett brett spektrum av molekylära reaktioner. Det faktum att det är en mycket stabil reaktion skapad utan behov av specifika förhållanden. innebär att det har potential för en låg kostnad kommersiell tillämpning vid produktion av nya läkemedel. Vi tror att vi har låst upp en ny kombination i de katalytiska triaderna som naturen verkar ha missgynnat, eventuellt för att skärpa kontrollen av reaktivitet, men det kan för en kemist vara en riktig guldgruva."