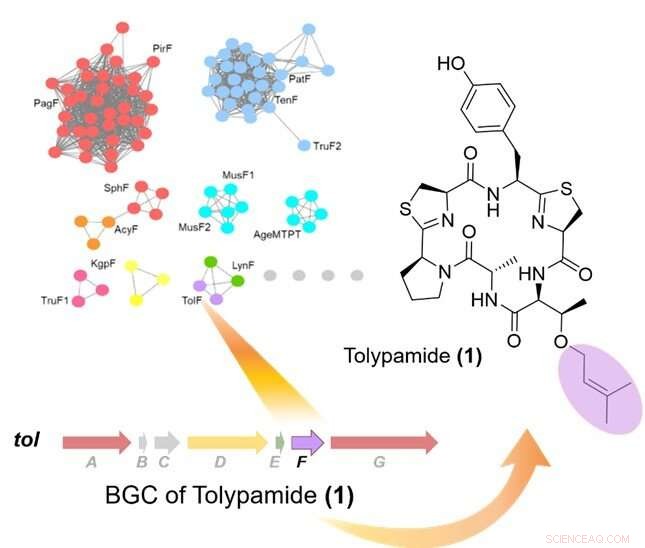
Figur 1:Riktad genombrytning av prenyltransferaser identifierade TolF-enzymet och till mig biosyntetiskt genkluster (BGC). Längst upp till vänster visar ett proteinsekvenslikhetsnätverk av prenyltransferaser. Det biosyntetiska genklustret för till mig vägen visas och var kopplad till biosyntesen av tolypamid. Tolypamid innehåller en framåtriktad prenylerad treoninrest (färgad i lila). Kredit:National University of Singapore
Forskare från NUS använde en genombrytning för att identifiera en ny cyklisk peptid (tolypamid) som härrör från en cyanobakterie. Biosyntesen av tolypamid innehåller en ny typ av enzym som kan prenylera en rad substrat och som har potentiell användning inom farmaceutisk kemi och syntetisk biologi.
Bioaktiva peptider har säkrat ett fäste på läkemedelsmarknaden på grund av de många fördelarna som effektiv inriktning av protein-proteininteraktioner, låga effekter utanför målet, och låg toxicitet. Dessa fördelar äventyras ofta på grund av dålig biotillgänglighet och cellpermeabilitet. Ett sätt att förbättra membranpermeabiliteten är att öka lipofilicitet genom att lägga till en alkylkedja till molekylen (prenylering). Dessa förvandlingar, som kan katalyseras av enzymer som är involverade i biosyntesen av naturliga cyanobaktinprodukter, kan potentiellt öka den terapeutiska effekten av omodifierade peptider. Också, cyanobaktin -enzymer har bred substratselektivitet och verkar på ett mycket selektivt och specifikt sätt med avseende på positionen och orienteringen av aminosyraresterna. Att förstå logiken bakom selektiviteten och specificiteten hos dessa katalysatorer kommer att hjälpa till att utnyttja förmågan hos dessa enzymer som biokemiska verktygssatser.
I samarbete med en internationell forskargrupp, Prof Brandon Morinaka från Institutionen för farmaci, National University of Singapore upptäckte en ny typ av cyanobaktinenzym som kallas ToIF. Det uppvisar specifik selektivitet för modifiering av serin- och treoninrester i peptider. Detta arbete är ett gemensamt forskningsarbete med professor Eric Schmidt från University of Utah och Dr. Muriel Gugger från Institut Pasteur. Proteiner från en underfamilj av prenyltransferaser kartlades till ett sekvenslikhetsnätverk.
Forskarna tillämpade riktad genombrytning för att analysera de genkluster som kodar dessa proteiner och identifierade ToIF -enzym och tol biosyntetisk väg. De fann att TolF -enzymet är involverat i produktionen av tolypamid som har en hydrofob prenylfunktionell grupp fäst vid dess struktur (Figur 1). Sådana molekylära bindningar är användbara för att förbättra membranpermeabiliteten hos terapeutiska föreningar. TolF-enzymet validerades funktionellt genom in vitro-biosyntes av tolypamidnaturprodukten (Figur 2). Ytterligare biokemiska analyser visar att TolF -enzymet också kan underlätta framåtprenylering av treonin- och serinrester på olika syntetiska peptider.
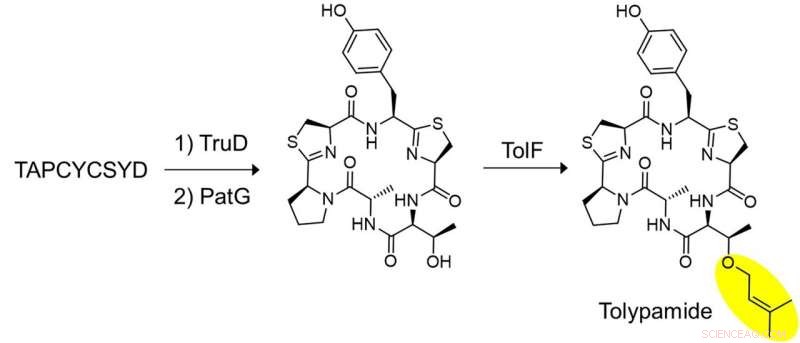
Figur 2:In vitro biosyntes av tolypamid och funktionell validering av TolF. En nyckeluppsättning experiment utfördes för att visa att TolF verkar på den heterocykliserade cykliska peptiden. Den syntetiserade peptiden, TAPCYCSYD inkuberades sekventiellt med enzymerna, TruD (heterocyklas) och PatG (makrocyklas) för att tillhandahålla den heterocykliserade cykliska peptiden. Inkubation med TolF gav kvantitativ omvandling till naturprodukten tolypamid. Kredit:National University of Singapore
Hittills, den enda andra medlemmen av denna klass av enzymer (prenyltransferas) som identifierats för att verka på serin- eller treoninrester är TruF1. Dock, dess dåliga löslighet och låga aktivitet in vitro har förhindrat omfattande karakterisering. Upptäckten av TolF ger en möjlighet att studera den strukturella biologin och evolutionen av denna enzymfamilj.
Prof Morinaka sa, "Ytterligare karakterisering av TolF-enzymet kommer att möjliggöra en mer fullständig förståelse av substratspecificitet och selektivitet hos prenyltransferaser. Detta kommer att underlätta den rationella konstruktionen av dessa biokatalysatorer som kraftfulla verktyg inom syntetisk biologi."