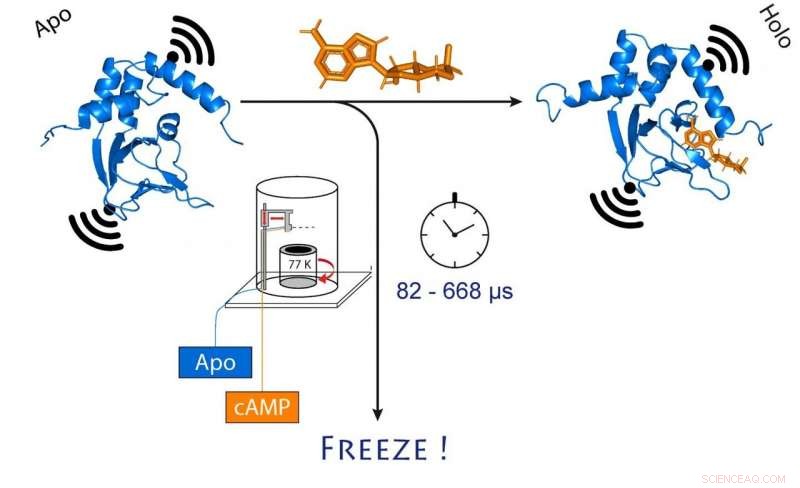
när cAMP (orange) binder. Detta ändrar också avståndet mellan de två molekylära magneterna fästa vid kanalen (svart). Kredit:(c) Tobias Hett / Universität Bonn und Forschungszentrum caesar
Forskare vid universitetet i Bonn och forskningscentret caesar har lyckats med ultrasnabb frysning av proteiner efter en exakt definierad tidsperiod. De kunde följa strukturella förändringar på mikrosekundsskala och med subnanometerprecision. På grund av dess höga rumsliga och tidsmässiga upplösning, metoden möjliggör spårning av snabba strukturella förändringar i enzymer och nukleinsyror. Resultaten publiceras i Journal of the American Chemical Society.
Om du vill veta hur den rumsliga strukturen hos en biomolekyl ser ut, du har en formidabel arsenal av verktyg till ditt förfogande. De mest populära är elektronmikroskopi och röntgendiffraktion, som kan avslöja även de minsta detaljerna i ett protein. Dock, en betydande begränsning av dessa metoder är att de vanligtvis levererar statiska bilder, som ofta är otillräckliga för att förstå biomolekylära processer i exakta mekanistiska termer. Därför, ett långsiktigt mål för många forskargrupper världen över har varit att spåra rörelserna inom en makromolekyl som ett protein över tiden medan den utför sitt arbete, precis som i en film. Forskargrupperna ledda av prof. Dr. Olav Schiemann från Institutet för fysisk och teoretisk kemi vid universitetet i Bonn och prof. dr. Benjamin Kaupp från forskningscentret Caesar of the Max Planck Society har nu kommit ett steg närmare att uppnå detta. mål.
De valde en jonkanal för sin undersökning. Detta är ett protein som bildar små porer i cellmembranet som är permeabla för laddade partiklar som kallas joner. "Denna kanal är normalt stängd, Schiemann förklarar. "Den öppnas bara när en mobilbudbärare, kallas cAMP, binder till det. Vi ville veta exakt hur den här processen fungerar."
Minimagneter för att mäta avstånd
Att göra så, forskarna blandade först kanalproteinet och cAMP och frös sedan snabbt lösningen. I fruset tillstånd, proteinstrukturen kan nu analyseras. För att deras metod ska fungera, de hade fäst molekylära elektromagneter på två punkter i kanalen. Avståndet mellan dessa magneter kan bestämmas med en precision på några Ångström (tio miljarddelar av en millimeter) med en sofistikerad metod som kallas PELDOR, som fungerar som en molekylär linjal. På senare år har metoden förfinades och förbättrades avsevärt i Schiemanns grupp.
"Dock, detta ger oss bara en statisk bild av cAMP som binder till jonkanalen, ", säger Schiemann. "Vi upprepade därför frysningsprocessen vid olika tidpunkter efter att ha blandat de två molekylerna. Detta gjorde det möjligt att rekonstruera rörelserna i proteinet efter cAMP-bindning - precis som en film, som också består av en sekvens av bilder."
I centrum för denna procedur är en sofistikerad metod som gör att prover kan blandas och frysas mycket snabbt vid en exakt tidpunkt. Tekniken, kallas "microsecond freeze hyperquenching" (förkortat MHQ), utvecklades ursprungligen vid Delfts universitet, men föll senare ur bruk. Den återupptäcktes och förfinades avgörande av Kaupps grupp.
"I MHQ-enheten, cAMP-molekylen och jonkanalen blandas vid ultrasnabb hastighet, Köpp förklarar. "Då skjuts blandningen som en hårtunn stråle på en mycket kall metallcylinder vid -190 °C, som roterar 7, 000 gånger per minut. Det var särskilt utmanande att överföra de frysta proverna för PELDOR-mätningen från metallplattan till tunna glasrör, och att hålla dem frysta under tiden. Vi var tvungna att designa och bygga specialverktyg för det."
Djupfrysning på 82 miljondelar av en sekund
Hela blandnings- och frysprocessen tar bara 82 mikrosekunder (en mikrosekund motsvarar en miljondels sekund). "Detta tillåter oss att visualisera mycket snabba förändringar i den rumsliga strukturen av proteiner, " förklarar Tobias Hett, en av de två doktorander som bidrog väsentligt till framgången. Fördelen med metoden är dess kombination av hög rumslig och tidsmässig upplösning. "Detta representerar ett stort steg framåt för att studera dynamiska processer i biomolekyler, " understryker Kaupp.
Forskarna planerar nu att använda sin metod för att titta närmare på andra biomolekyler. De hoppas få nya insikter, till exempel i funktionen av enzymer och nukleinsyror. Vikten av sådana insikter illustreras bäst av den senaste världsomspännande ökningen av strukturell forskning om SARS coronavirus-2:Virusets så kallade spikprotein genomgår också en strukturell förändring när mänskliga celler infekteras. Att förtydliga denna mekanism kommer att ge värdefull information om hur man riktar in sig på infektionsmekanismen med nya läkemedel.
Beredningen av proverna, det experimentella utförandet, och analysen av data är mycket komplex. Resultaten av studien speglar därför också ett framgångsrikt vetenskapligt samarbete med forskare under ledning av prof. Dr. Helmut Grubmüller från Max Planck-institutet för biofysikalisk kemi i Göttingen och prof. dr. Heinz-Jürgen Steinhoff vid universitetet i Osnabrück.