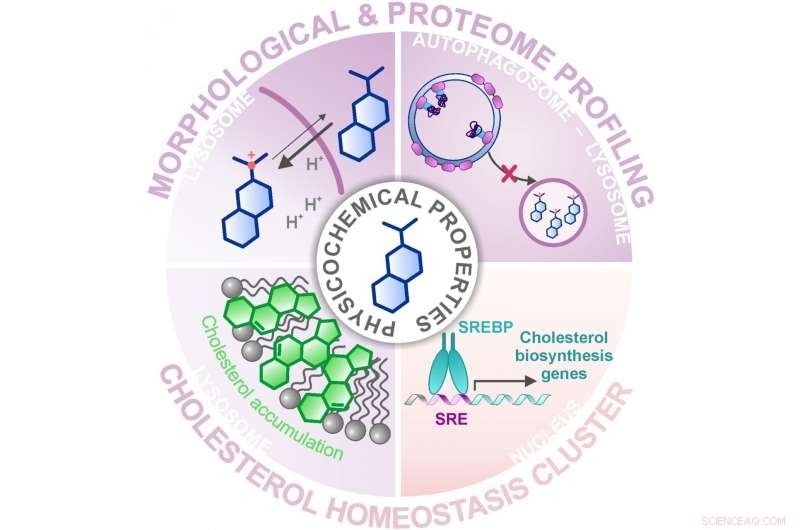
Att tillämpa den morfologiska och proteomprofileringen, en grupp av redan karakteriserade substanser identifierades som modulerar kolesterolhomeostasen. Kredit:MPI of Molecular Physiology
När Alexander Flemming upptäckte en mögel på en odlingsplatta övervuxen med bakterier 1928, han förväntade sig inte att hitta en av de mest använda aktiva substanserna:penicillin. Oavsiktliga upptäckter och identifiering av aktiva ingredienser från traditionella läkemedel, såsom morfin från opiumvallmo, har format upptäckten av nya mediciner under lång tid.
Modern läkemedelsupptäckt – från slump till system
Under tiden, stora utvecklingar inom kemi och molekylärbiologi har gjorts som möjliggör ett systematiskt och målinriktat sökande efter potentiella aktiva substanser i modern läkemedelsupptäckt. Först, framsteg inom området organisk och särskilt kombinatorisk kemi gjorde det möjligt att producera enorma substansbibliotek och testa dem med avseende på deras farmakologiska effekt i tester med hög genomströmning. Efter tekniska framsteg som sekvensering av det mänskliga genomet och utvecklingen av nya metoder inom molekylärbiologi möjliggjorde identifiering av sjukdomsrelaterade cellulära processer och deras molekylära nyckelspelare. Detta banade vägen mot modern drogupptäckt, där stora bibliotek av molekyler screenas på ett sätt med hög genomströmning för deras inverkan på relevanta målmolekyler, mestadels proteiner. Identifierade ämnen, så kallade träffar, är optimerade i sin kemiska struktur för att leda strukturer som redan är effektiva i små doser och som absorberas väl och fördelas i kroppen.
Ingen effekt utan biverkningar
Denna målbaserade läkemedelsutveckling är mycket framgångsrik när det gäller att identifiera nya läkemedelskandidater som förhindrar målproteinerna från att fungera eller interagera med andra proteiner. Dock, potentiella läkemedelskandidater är sällan specifika och verkar mycket ofta också på relaterade proteiner som har liknande funktion eller struktur. "Det är inte ovanligt att en från början lovande läkemedelskandidat oväntat visar allvarliga biverkningar i en senare fas av sin långvariga utveckling, på så sätt begränsa eller till och med förhindra dess kliniska användning, säger Slava Ziegler.
På jakt efter okända bioaktiviteter
För att spåra möjliga biverkningar under läkemedelsutveckling, potentiella läkemedelskandidater screenas i analyser för deras effekt på kända proteinklasser, biologiska processer och vissa cellulära egenskaper. Dock, dessa tester kan bara återspegla den förväntade bioaktiviteten eftersom antalet kända målmolekyler i cellen är begränsat. Så kallade profileringsmetoder erbjuder nu möjligheten att upptäcka ett bredare spektrum av aktivitet. Dessa opartiska tester undersöker påverkan på hundratals cellulära eller genetiska parametrar registrerade i ett ämnes profil som jämförs med profiler för referensämnen med kända effekter.
När läkemedelsprofiler matchar
I deras senaste studie, gruppen av Herbert Waldmann och Slava Ziegler kombinerade två av dessa profileringsmetoder för att identifiera bioaktiva substanser från ett bibliotek med cirka 15 000 naturliga produktinspirerade molekyler och jämförde dem med profilerna för kända, aktiva föreningar. Att tillämpa cellmålningsanalysen, där funktionella områden i cellen färgas och sedan mikroskopiskt undersöks för förändringar, ett stort kluster av ämnen med liknande profiler identifierades. Dock, det var inte möjligt att förutsäga klustrets verkningssätt eftersom de associerade referensföreningarna hade olika aktiviteter eller målmolekyler. Med en efterföljande sökning med proteomprofilering, där mängderna och därmed regleringen av tusentals proteiner undersöktes, forskarna kunde begränsa klustret till en gemensam aktivitet – moduleringen av kolesterolhomeostas – en oväntad biologisk aktivitet för de flesta referensämnena i klustret.
Två flugor i en smäll:Identifiera nya bioaktiviteter och biverkningar
Men hur kan ämnen med väldigt olika målmolekyler utlösa samma effekt? Forskarna avslöjade att de flesta av föreningarna i klustret ackumuleras i lysosomen, en organell där kolesterol lagras tillfälligt för dess vidare funktion i cellen. Lysosomen har ett lägre pH-värde än resten av cellen, och detta är avgörande för funktionen hos de lysosomala matsmältningsenzymer som bearbetar främmande och cellens egna biomolekyler. I lysosomen, ämnena från det beskrivna klustret ökar pH-värdet och stör därmed funktionen hos denna organell och, särskilt, cellens kolesterolbalans. Att föreningarna ackumuleras i lysosomen beror inte på en specifik målmolekyl i lysosomen utan på deras kemiska och fysikaliska egenskaper, som de har erhållit genom sin strukturoptimering för förbättrad löslighet.
"Intressant, störd kolesterolbalans har redan kopplats till vissa läkemedel på marknaden, såsom antipsykotika", säger Tabea Schneidewind, första författare till studien. " Med kombinationen av de två sökstrategierna, vi kan slå två flugor i en smäll:avslöja okända biverkningar och identifiera nya aktiva substanser och verkningssätt", säger Slava Ziegler.
Inriktning på kolesterolhomeostas kan möjligen också störa SARS-CoV-2-infektioner
Att påverka kolesterolhomeostas verkar vara ett vanligt kännetecken för många föreningar och bör beaktas vid utvärdering av biverkningar av aktiva substanser. Dock, den observerade aktiviteten är inte i sig oönskad. För närvarande, läkemedel och föreningar med kända verkningsmekanismer studeras intensivt för hämning av SARS-CoV-2-infektion av värdceller, och många föreningar i vårt kluster har identifierats för att undertrycka denna process. Intressant, membrankolesterol och därmed korrekt kolesterolhomeostas är avgörande för Sars-CoV-2-infektion, vilket visats i flera studier. Våra data förklarar troligen orsaken till aktiviteten av dessa föreningar mot viruset:de förändrar kolesterolbiosyntesen och lokaliseringen i celler, som försämrar Corona-virusinfektion", säger Slava Ziegler.