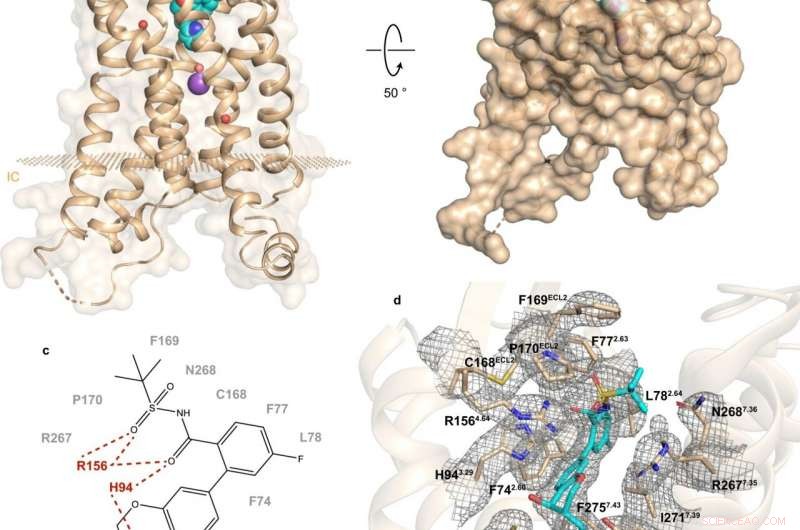
Fig. 1:Struktur och bindningsställe för hBLT1. Upphovsman:Michaelian, N., et al. Naturkommunikation , https://doi.org/10.1038/s41467-021-23149-1
Forskare från University of Southern California, Merck &Co., Skoltech, MIPT, UCLA, och Université de Sherbrooke har bestämt strukturen för den humana leukotrien B4 -receptorn 1, involverad i inflammatoriska, infektiös, allergisk, och tumörsjukdomar. Publicerad i Naturkommunikation , analysen av strukturen avslöjar hur receptorn känner igen sina bindande partner och interagerar med dem. Detta öppnar möjligheter för att designa bättre läkemedel som riktar sig till receptorn för att behandla typ 2 -diabetes och andra patologier.
Receptorer är den proteinbaserade utrustning som cellerna använder för att ta emot och överföra signaler. En receptor aktiveras när den binder en budbärarmolekyl som kallas en agonist, varpå den vidarebefordrar signalen, som reglerar viss biologisk funktion. Antagonister, däremot, stäng av receptorn när den är bunden. Agonister och antagonister kallas tillsammans ligander.
Den humana leukotrien B4 -receptorn 1, eller hBLT1, reglerar inflammationsrelaterade processer-såsom rekrytering av T-celler-liksom spridning och migration av glatta muskelceller. Att receptorn har associerats med sjukdomar, inklusive astma, influensa, artrit, åderförkalkning, diabetes, och cancer.
Sedan upptäckten 1997, det har gjorts ett antal försök att utveckla hBLT1 -ligander för användning som läkemedel, men de hade många biverkningar, låg effekt, och kroppen tog relativt lång tid att eliminera dem. En trolig förklaring till detta är att de hBLT1 -ligander som används inte är specifika för den receptorn och deltar i andra oönskade interaktioner. Att lära sig mer om receptorns struktur och hur den binder ligander kan göra det möjligt för farmakologer att designa bättre, mer selektiva läkemedel.
En nyligen genomförd studie av ett rysk-amerikansk-kanadensiskt samarbete belyser smink och funktion av hBLT1. Vadim Cherezov, professor i kemi vid USC och chef för MIPT Laboratory for Structural Biology of GPCRs, kommenterade:"Vi har bestämt 2,9-ångström-upplösning kristallstrukturen för hBLT1-receptorn i komplex med en selektiv antagonist, MK-D-046, utvecklad av Merck &Co.
Strukturbestämning kompletterades med platsinriktad mutagenes och dockningsstudier-en experimentell och en beräkningsmetod, respektive. Enligt Skoltech biträdande professor Petr Popov, "detta gjorde det möjligt att avslöja de viktigaste determinanterna för intermolekylära interaktioner mellan receptorn och liganderna."
Analysen av hBLT1 -strukturen avslöjar hur receptorn känner igen och binder ligander, föreslår en förmodad ligandåtkomstkanal begravd i receptorns membran. Mer specifikt, resultaten tyder på de möjliga sätt som receptorn kan binda sina endogena agonister. Det är, föreningar som naturligt produceras av kroppen för att binda till den receptorn och aktivera den.
Genom att förbättra vår förståelse av hBLT1 -struktur och funktion, studien öppnar möjligheter för strukturbaserad läkemedelsdesign.