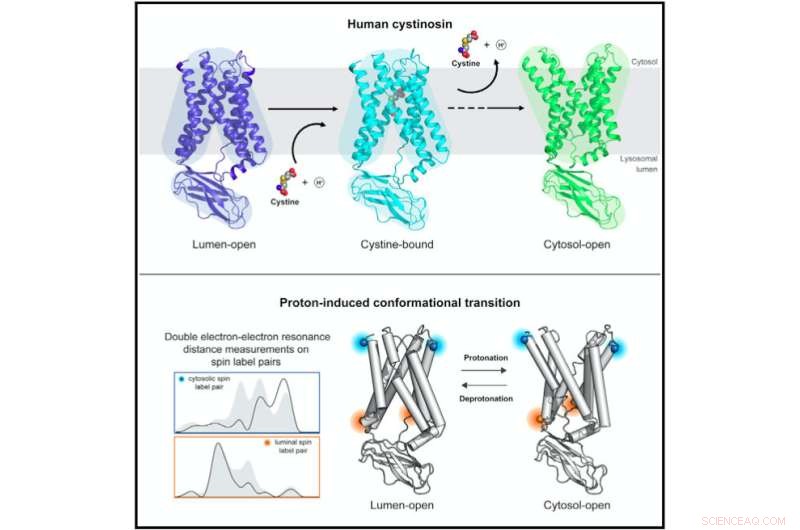
Strukturella och biofysiska studier av humant cystinosin avslöjar molekylära mekanismer och konformationsdynamik i protonkopplad lysosomal aminosyratransport. Kredit:Guo et al., Cell 2022
Den sällsynta genetiska sjukdomen cystinos orsakas av mutationer i genen för ett protein som kallas cystinosin. Ett team av forskare har nu löst strukturen av cystinosin och bestämt hur mutationer stör dess normala funktion, vilket ger insikter i de underliggande mekanismerna och föreslår ett sätt att utveckla nya behandlingar för sjukdomen.
Den nya studien, publicerad 15 september i Cell , involverade ett samarbete mellan forskare vid UC Santa Cruz, Stanford University och University of Texas Southwestern Medical Center, som kombinerade sin expertis inom tre specialiserade metoder för att studera proteinstruktur och funktion:röntgenkristallografi, kryogen elektronmikroskopi (kryo- EM), och dubbel elektron-elektronresonans (DEER).
"Den här artikeln kan sätta en modell för hur man kombinerar dessa tre områden, tillsammans med biokemiska analyser, för att snabbt begränsa hur ett protein fungerar och identifiera en terapeutisk strategi", säger Glenn Millhauser, framstående professor och ordförande i kemi och biokemi vid UC Santa Cruz och en motsvarande författare till tidningen.
Cystinosin är ett specialiserat transportprotein som spelar en avgörande roll i hur celler hanterar den essentiella aminosyran cystein. Celler återvinner ständigt proteiner och bryter ner dem till sina ingående aminosyror för att användas för att bygga nya proteiner. Transportörer som cystinosin flyttar aminosyrorna ut ur lysosomerna - de cellulära avdelningarna där proteiner bryts ner - in i cellen för att återanvändas. När cystinosin inte fungerar korrekt på grund av mutationer, byggs en form av cystein (en dimer som kallas cystin) upp inuti lysosomerna.
Den onormala ansamlingen av cystin orsakar omfattande skador på vävnader och organ och kan leda till njursvikt, muskelförtvining och andra problem.
"Det är en sällsynt sjukdom, men den kan vara dödlig," sa Millhauser. "Om det är obehandlat dör personer med cystinos vanligtvis vid tio års ålder."
Cystinosin antar olika konformationer när den är öppen mot insidan av lysosomen för att ladda cystin och när den är öppen mot utsidan för att frigöra cystin. Forskarteamen vid Stanford (ledda av professor Liang Feng) och vid UT Southwestern (ledda av professor Xiaochun Li) löste strukturerna för cystinosin i dessa olika strukturella konformationer med hjälp av röntgenkristallografi och kryo-EM.
För att förstå cystinosins strukturella förändringar genom transportprocessen krävdes dock DEER-studierna utförda av Millhausers labb. DEER är en specialiserad magnetisk resonansteknik som kan användas för att bestämma hur ett protein ändrar sin form.
"Med det kunde vi ta reda på mekanismen som gör att cystinosin kan växla mellan dessa olika tillstånd, och vi kunde begränsa vilka av proteinets aminosyror som drev övergången," sa Millhauser. "Nu kan vi se hur mutationerna förändrar proteinets förmåga att ändra form och pumpa ut cystin ur lysosomen."
Dessa nya insikter i den molekylära mekaniken för cystinosins transportaktivitet ger inte bara en mer detaljerad förståelse av patogenesen av cystinos, utan föreslår också en möjlig terapeutisk strategi för att behandla sjukdomen. "Det kan vara möjligt att förbättra transportaktiviteten av cystinosin genom att utveckla konformationsselektiva små molekyler eller biologiska läkemedel som gynnar en cytosolöppen konformation", skrev författarna.
Ett liknande tillvägagångssätt skulle kunna användas för att rikta in sig på andra transportörproteiner, som är involverade i ett brett spektrum av sjukdomar. + Utforska vidare