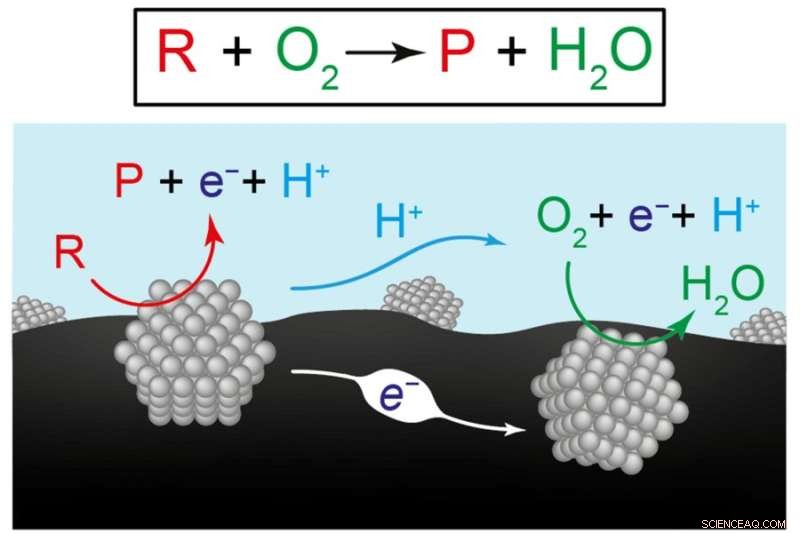
Denna figur visar två vyer av de kemiska reaktionerna för att producera förnybara bränslen och kemikalier. Den översta ekvationen representerar omvandlingen av reaktanten (R) plus syre (O2) till en produkt (P) plus vatten (H2O). Diagrammet nedan illustrerar forskarnas hypotes att den totala reaktionen är resultatet av två koordinerade halvreaktioner som inträffar på separata katalysatormaterial, här representerade av grå strukturer. På den vänstra katalysatorn förvandlas reaktanten till en produkt som skickar elektroner (e-) in i kolbärarmaterialet (svart) och protoner (H+) till vatten (blått). På den högra katalysatorn förbrukas elektroner och protoner när de driver reaktionen mellan syre och vatten. Kredit:Bild med tillstånd av forskarna.
En utmaning för att minska koldioxidutsläppen i energisystemet är att veta hur man ska hantera nya typer av bränslen. Traditionella bränslen som naturgas och olja kan kombineras med andra material och sedan värmas upp till höga temperaturer så att de kemiskt reagerar för att producera andra användbara bränslen eller ämnen, eller till och med energi för att utföra arbete. Men nya material som biobränslen kan inte ta lika mycket värme utan att gå sönder.
En nyckelingrediens i sådana kemiska reaktioner är en specialdesignad fast katalysator som tillsätts för att uppmuntra reaktionen att inträffa men som inte själv förbrukas i processen. Med traditionella material interagerar den fasta katalysatorn typiskt med en gas; men med bränslen som härrör från biomassa, till exempel, måste katalysatorn fungera med en vätska – en speciell utmaning för dem som designar katalysatorer.
I nästan ett decennium har Yogesh Surendranath, docent i kemi vid MIT, fokuserat på kemiska reaktioner mellan fasta katalysatorer och vätskor, men i en annan situation:snarare än att använda värme för att driva reaktioner, matar han och hans team in elektricitet från en batteri eller en förnybar källa som vind eller sol för att ge kemiskt inaktiva molekyler mer energi så att de reagerar. Och nyckeln till deras forskning är att designa och tillverka fasta katalysatorer som fungerar bra för reaktioner som involverar vätskor.
Surendranath insåg behovet av att använda biomassa för att utveckla hållbara flytande bränslen och undrade om han och hans team kunde ta principerna de har lärt sig om att designa katalysatorer för att driva vätske-fasta reaktioner med elektricitet och tillämpa dem på reaktioner som sker vid vätske-fasta gränssnitt utan någon inmatning av el.
Till sin förvåning fann de att deras kunskap är direkt relevant. Varför? "Vad vi hittade - förvånansvärt nog - är att även när du inte ansluter kablar till din katalysator, finns det små interna "ledningar" som gör reaktionen", säger Surendranath. "Så, reaktioner som folk i allmänhet tror fungerar utan strömflöde involverar faktiskt elektroner som flyttar från en plats till en annan." Och det betyder att Surendranath och hans team kan ta med de kraftfulla teknikerna inom elektrokemin till problemet med att designa katalysatorer för hållbara bränslen.
En ny hypotes
Deras arbete har fokuserat på en klass av kemiska reaktioner som är viktiga i energiövergången som involverar tillsats av syre till små organiska (kolhaltiga) molekyler som etanol, metanol och myrsyra. Det konventionella antagandet är att reaktanten och syret reagerar kemiskt för att bilda produkten plus vatten. Och en fast katalysator - ofta en kombination av metaller - finns närvarande för att tillhandahålla platser där reaktanten och syret kan interagera.
Men Surendranath föreslog en annan syn på vad som händer. I den vanliga uppställningen är två katalysatorer, var och en sammansatt av många nanopartiklar, monterade på ett ledande kolsubstrat och nedsänkt i vatten. I det arrangemanget kan negativt laddade elektroner strömma lätt genom kolet, medan positivt laddade protoner lätt kan strömma genom vatten.
Surendranaths hypotes var att omvandlingen av reaktant till produkt fortskrider med hjälp av två separata "halvreaktioner" på de två katalysatorerna. På en katalysator förvandlas reaktanten till en produkt som i processen skickar elektroner in i kolsubstratet och protoner i vattnet. Dessa elektroner och protoner plockas upp av den andra katalysatorn, där de driver omvandlingen av syre till vatten. Så istället för en enda reaktion uppnår två separata men koordinerade halvreaktioner nettoomvandlingen av reaktant till produkt.
Som ett resultat involverar den övergripande reaktionen faktiskt inte någon nettoelektronproduktion eller -konsumtion. Det är en vanlig "termisk" reaktion som härrör från energin i molekylerna och kanske lite extra värme. Det konventionella tillvägagångssättet för att utforma en katalysator för en sådan reaktion skulle fokusera på att öka hastigheten för denna reaktant-till-produkt-omvandling. Och den bästa katalysatorn för den typen av reaktion kan visa sig vara, säg, guld eller palladium eller någon annan dyr ädelmetall.
Men om den reaktionen faktiskt involverar två halvreaktioner, som Surendranath föreslog, finns det ett flöde av elektrisk laddning (elektroner och protoner) mellan dem. Så Surendranath och andra inom området kunde istället använda tekniker inom elektrokemi för att designa inte en enda katalysator för den övergripande reaktionen utan snarare två separata katalysatorer - en för att påskynda en halvreaktion och en för att påskynda den andra halvreaktionen. "Det betyder att vi inte behöver designa en katalysator för att göra allt det tunga arbetet med att påskynda hela reaktionen", säger Surendranath. "Vi kanske kan koppla ihop två billiga, jordnära katalysatorer, som var och en gör hälften av reaktionen bra, och tillsammans utför de den övergripande omvandlingen snabbt och effektivt."
Men det finns ytterligare ett övervägande:Elektroner kan flöda genom hela katalysatorkompositen, som omfattar katalysatorpartiklarna och kolsubstratet. För att den kemiska omvandlingen ska ske så snabbt som möjligt måste hastigheten med vilken elektroner förs in i katalysatorkompositen exakt matcha hastigheten med vilken de tas ut. Med fokus på bara elektronerna, om reaktionen till produkt-omvandlingen på den första katalysatorn skickar samma antal elektroner per sekund in i "elektronbadet" i katalysatorkompositen som syre-till-vatten-omvandlingen på den andra katalysatorn tar ut kommer de två halvreaktionerna att balanseras, och elektronflödet – och hastigheten för den kombinerade reaktionen – kommer att vara snabbt. Tricket är att hitta bra katalysatorer för var och en av halvreaktionerna som är perfekt matchade när det gäller elektroner in och elektroner ut.
"En bra katalysator eller ett par katalysatorer kan upprätthålla en elektrisk potential - i huvudsak en spänning - vid vilken båda halvreaktionerna är snabba och balanserade", säger Jaeyune Ryu Ph.D. '21, en tidigare medlem av Surendranath-labbet och huvudförfattare till studien; Ryu är nu postdoc vid Harvard University. "Reaktionshastigheterna är lika, och spänningen i katalysatorkompositen kommer inte att förändras under den totala termiska reaktionen."
Riktning på elektrokemi
Baserat på sin nya förståelse vände sig Surendranath, Ryu och deras kollegor till elektrokemitekniker för att identifiera en bra katalysator för varje halvreaktion som också skulle kunna fungera bra tillsammans. Deras analytiska ramverk för att vägleda katalysatorutveckling för system som kombinerar två halvreaktioner är baserad på en teori som har använts för att förstå korrosion i nästan 100 år, men som sällan har använts för att förstå eller designa katalysatorer för reaktioner som involverar små molekyler som är viktiga för energy transition.
Key to their work is a potentiostat, a type of voltmeter that can either passively measure the voltage of a system or actively change the voltage to cause a reaction to occur. In their experiments, Surendranath and his team use the potentiostat to measure the voltage of the catalyst in real time, monitoring how it changes millisecond to millisecond. They then correlate those voltage measurements with simultaneous but separate measurements of the overall rate of catalysis to understand the reaction pathway.
For their study of the conversion of small, energy-related molecules, they first tested a series of catalysts to find good ones for each half-reaction—one to convert the reactant to product, producing electrons and protons, and another to convert the oxygen to water, consuming electrons and protons. In each case, a promising candidate would yield a rapid reaction—that is, a fast flow of electrons and protons out or in.
To help identify an effective catalyst for performing the first half-reaction, the researchers used their potentiostat to input carefully controlled voltages and measured the resulting current that flowed through the catalyst. A good catalyst will generate lots of current for little applied voltage; a poor catalyst will require high applied voltage to get the same amount of current. The team then followed the same procedure to identify a good catalyst for the second half-reaction.
To expedite the overall reaction, the researchers needed to find two catalysts that matched well—where the amount of current at a given applied voltage was high for each of them, ensuring that as one produced a rapid flow of electrons and protons, the other one consumed them at the same rate.
To test promising pairs, the researchers used the potentiostat to measure the voltage of the catalyst composite during net catalysis—not changing the voltage as before, but now just measuring it from tiny samples. In each test, the voltage will naturally settle at a certain level, and the goal is for that to happen when the rate of both reactions is high.
Validating their hypothesis and looking ahead
By testing the two half-reactions, the researchers could measure how the reaction rate for each one varied with changes in the applied voltage. From those measurements, they could predict the voltage at which the full reaction would proceed fastest. Measurements of the full reaction matched their predictions, supporting their hypothesis.
The team's novel approach of using electrochemistry techniques to examine reactions thought to be strictly thermal in nature provides new insights into the detailed steps by which those reactions occur and therefore into how to design catalysts to speed them up. "We can now use a divide-and-conquer strategy," says Ryu. "We know that the net thermal reaction in our study happens through two 'hidden' but coupled half-reactions, so we can aim to optimize one half-reaction at a time"—possibly using low-cost catalyst materials for one or both.
Adds Surendranath, "One of the things that we're excited about in this study is that the result is not final in and of itself. It has really seeded a brand-new thrust area in our research program, including new ways to design catalysts for the production and transformation of renewable fuels and chemicals." + Utforska vidare
Denna berättelse är återpublicerad med tillstånd av MIT News (web.mit.edu/newsoffice/), en populär webbplats som täcker nyheter om MIT-forskning, innovation och undervisning.