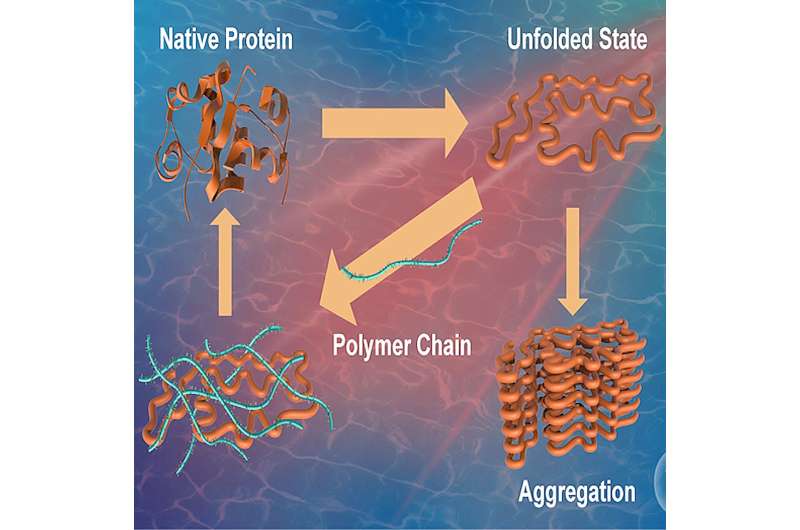
Proteiner är vitala biomolekyler som är ansvariga för att utföra olika funktioner i människokroppen och betraktas därför som en cells arbetshästar. Den primära strukturen hos ett protein är sammansatt av olika aminosyror som samlas. Den så bildade strukturen genomgår sedan proteinveckning, en process genom vilken ett protein får sin karakteristiska och funktionella tredimensionella konfiguration.
Detta tillstånd, kallat "native state", är avgörande för korrekt proteinfunktion. Ogynnsamma förhållanden, såsom stress eller exponering för yttre ämnen, kan orsaka att proteiner felveckas och bildar aggregat, vilket försämrar deras förmåga att utföra sina ursprungliga funktioner.
Proteinfelveckning har varit inblandad som den underliggande orsaken till en rad mänskliga sjukdomar, särskilt Alzheimers, Huntingtons och Parkinsons. Dessutom är aggregatbildning också känd för att påverka effektiviteten och säkerheten hos proteinbaserade läkemedel. Detta understryker behovet av att undersöka föreningar och strategier som kan undertrycka felveckning och förbättra proteinstabilisering.
Nyligen genomförda studier har rapporterat proteinstabiliseringsförmågan hos ett fåtal polymerer. Deras verkningsmekanism och effekterna av interaktioner mellan hydrofoba komponenter (komponenterna som stöter bort vatten) och proteiner är dock inte väl förstått.
För att komma till rätta med denna kunskapsklyfta har ett team av forskare lett av professor Kazuaki Matsumura från Japan Advanced Institute of Science and Technology (JAIST), inklusive tidigare biträdande professor Robin Rajan, doktorandforskare Dr. Dandan Zhao från JAIST och biträdande professor Tadaomi Furuta från Tokyo Institute of Technology, genomförde en studie för att klargöra mekanismen för proteinaggregationshämning av sulfobetain (SPB).
I deras studie publicerad i Cell Reports Physical Science , försökte forskarna också förstå de specifika interaktioner som sker mellan hydrofoba komponenter och proteiner och deras inverkan på proteinaggregation.

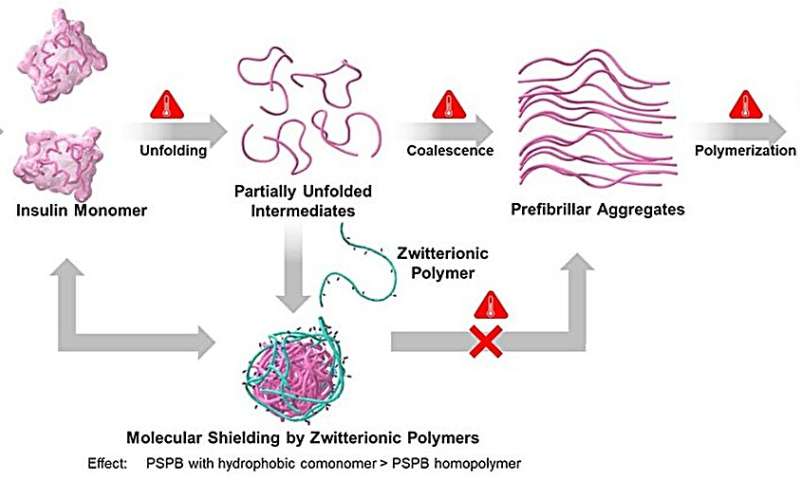
Prof. Matsumura förklarar logiken bakom denna studie och säger:"Tidigare genomförde vi en studie på polysulfobetainer (PSPBs), en zwitterjonisk polymer som består av funktionella grupper med både positiva och negativa laddningar. Vi fann att polymeren visade exceptionell effektivitet när det gäller att undertrycka proteinaggregation. Men effekten av hydrofobicitet förblev outforskad."
I denna studie syntetiserade forskarna PSPBs med olika molekylvikter och tillsatte varierande mängder hydrofoba monomerer individuellt och med olika alkylkedjor genom en process som kallas reversibel additionsfragmenteringskedjeöverföringspolymerisation. Forskarna analyserade sedan dessa polymerers proteinstabiliserande egenskaper och undersökte interaktionerna mellan polymerer och proteiner genom fysikalisk-kemiska tekniker.
Deras resultat avslöjade att PSPB erbjöd proteinstabilisering genom att störa de viktiga vägarna som är involverade i proteinaggregation. Vidare hade hydrofobicitet och molekylvikt båda ett inflytande på att förhindra proteinaggregation och förbättra proteinstabilisering. Genom att öka dessa faktorer förstärktes de svaga och reversibla interaktionerna mellan SPB och proteiner.
"Vi kan tänka på dessa polymerer som reversibla molekylära sköldar, som stör aggregationsvägen", förklarar Prof. Matsumura, medan han diskuterar resultaten av deras studie. Forskarna fann också att vid avlägsnande av stress observerades återveckning av de delvis ovikta intermediärerna, vilket tyder på att de återfick sina ursprungliga tillstånd.
Genom att reda ut de invecklade molekylära mekanismerna för undertryckande av proteinaggregation av zwitterjoniska polymerer, kan denna banbrytande studie öppna vägar för nya terapeutiska strategier som fördröjer eller förebygger sjukdomstillstånd och hjälper till att garantera säkerheten för proteinbaserade läkemedel.
Med professor Matsumura ord, "Om 5 till 10 år kan denna forskning leda till utvecklingen av nya, mer effektiva behandlingar för tillstånd relaterade till felveckning av proteiner, vilket avsevärt förbättrar patienternas resultat. Dessutom kan det möjliggöra produktionen av mer stabila och kostnadseffektiv proteinterapi, till fördel för läkemedelsindustrin och vårdgivare."
Mer information: Molekylär mekanism för proteinaggregationshämning med sulfobetainpolymerer och deras hydrofoba derivat, Cell Reports Physical Science (2024). DOI:10.1016/j.xcrp.2024.102012. www.cell.com/cell-reports-phys … 2666-3864(24)00280-7
Journalinformation: Cell Reports Physical Science
Tillhandahålls av Japan Advanced Institute of Science and Technology