Biokemister har länge arbetat kring en blind fläck när det kommer till proteiner. De vet att väte utgör nästan hälften av atomerna i proteiner, men hur de bidrar till proteinfunktionen i dessa komplexa strukturer har varit mindre tydligt. Väteatomer är så små att traditionella strukturbiologiska tekniker inte kan avslöja deras positioner.
"Så du saknar hälften av informationen", säger Dr. Victoria Drago, en postdoktorand forskningsassistent vid Oak Ridge National Laboratory (ORNL) i Tennessee och nyligen alumn från University of Toledo.
Att inte ha en fullständig redovisning av placeringen av ett proteins väteatomer är en gåta med implikationer utanför laboratoriet, inklusive i strukturbaserad läkemedelsdesign.
Drago började utforska en teknik för att lokalisera annars svårfångade väten som involverade odling av proteinkristaller i mikrogravitation som doktorand tillsammans med Dr. Timothy Mueser, professor vid UToledo Department of Chemistry and Biochemistry.
Analysen av dessa kristaller – en kemiterm som i det här fallet hänvisar till det exakta arrangemanget av de ingående atomerna och molekylerna – är grunden för en nyligen publicerad forskningsartikel i tidskriften Cell Reports Physical Science .
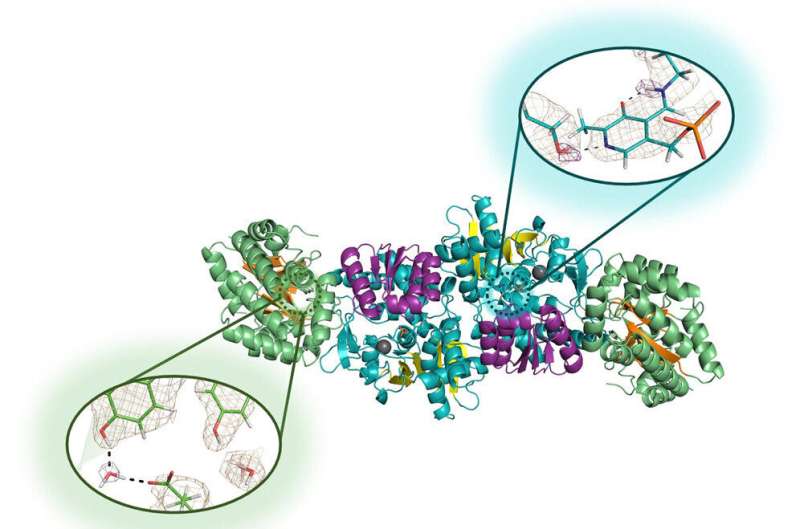
"Vi använde neutrondiffraktion", säger Drago, som är huvudförfattare till uppsatsen och som tog examen i kemi 2022. "Vi kunde utföra experimentet och uppnå hög upplösning genom att utnyttja mikrogravitationen för att odla högkvalitativa kristaller av enzymet."
Neutrondiffraktion är en högteknologisk process som gör det möjligt för forskare att kartlägga de exakta platserna för en molekyls varje enskild atom. Det fungerar för att identifiera platserna för små väteatomer, som med andra atomer, men signalen är extremt svag i traditionella strukturbiologiska tekniker. Det var därför de övergick till mikrogravitation, som möjliggör tillväxt av större och mer perfekt strukturerade kristaller.

Drago, Mueser och deras medarbetare vid ORNL och Institut Laue-Langevin, en ledande kärnforskningsanläggning i Grenoble, Frankrike, skickade upp lösningar av enzymet tryptofansyntas för en en månads turné på den internationella rymdstationen 2018, och igen för en sex månaders resa 2019 till 2020. Den andra resan gav flera mycket stora, perfekta kristaller – många ungefär en kubikmillimeter, fem gånger större än de forskare växte i laboratorier – som reste mer än 50 miljoner miles och överlevde ett 9G-stänk i Stilla havet.
Neutrondiffraktion visade sig vara framgångsrik på dessa kristaller, vilket gjorde det möjligt för forskarna att för första gången avslöja de aktiva väteämnena i enzymet de valde att studera.
Tryptofansyntas är vetenskapligt värdefullt som en representant för en stor och mycket mångsidig familj av enzymer som använder vitamin B6 för funktion. Eftersom människor inte producerar tryptofansyntas, är det också attraktivt för läkemedelsdesigners som är intresserade av att utnyttja den kemiska strukturen hos proteiner i sin utveckling av nya föreningar för att bekämpa patogena mikroorganismer som Salmonella enterica, Staphylococcus aureus och Mycobacterium tuberculosis.
Mer information: Victoria N. Drago et al, Neutrondiffraktion från en mikrogravitationsodlad kristall avslöjar de aktiva väteämnena i den interna aldiminformen av tryptofansyntas, Cell Reports Physical Science (2024). DOI:10.1016/j.xcrp.2024.101827
Journalinformation: Cell Reports Physical Science
Tillhandahålls av University of Toledo