Vissa typer av peptider och mikroproteiner för läkemedelsforskning kan göras mer effektivt och snabbare med hjälp av ett reaktionslösningsmedel som hjälper till att efterlikna naturens sätt.
Kemister kan nu producera en viktig klass av små proteiner som kallas cysteinrika peptider i deras naturligt vikta 3D-struktur mer tillförlitligt och mycket snabbare, tack vare metoder som efterliknar vad som händer inuti celler. Framsteg, som uppnåtts av forskare vid Xi'an Jiaotong-Liverpool University (XJTLU) i Kina och Nanyang Technological University (NTU) i Singapore, publiceras i tidskriften Angewandte Chemie .
Cystein är en av många olika aminosyramolekyler som kan bindas samman för att bilda proteinkedjor. Peptider är kedjor som är kortare än många naturliga proteiner. Cysteinmolekyler innehåller var och en en svavelatom som kan bindas till svavel från ett annat cystein någon annanstans i ett protein, vilket håller ihop olika delar av kedjan.
"Att återskapa 3D-formerna av cysteinrika peptider har alltid varit ett stort problem i deras tillverkning", säger Dr Shining Loo från XJTLU-teamet. Många bioaktiva proteiner och peptider har flera disulfidbindningar mellan cysteinaminosyror, vilket är avgörande för att bibehålla deras exakta 3D-vikta struktur. Läkemedel som linaklotid mot förstoppning och ziconotid mot kronisk smärta är exempel på cysteinrika peptidläkemedel på marknaden.
"Vår procedur bör låsa upp nya möjligheter för läkemedelsupptäckt och kostnadseffektiv tillverkning av cysteinrika mikroproteiner och peptider som terapeutiska medel", tillägger forskaren Dr. Antony Kam från XJTLU-teamet.
Naturens inflytande
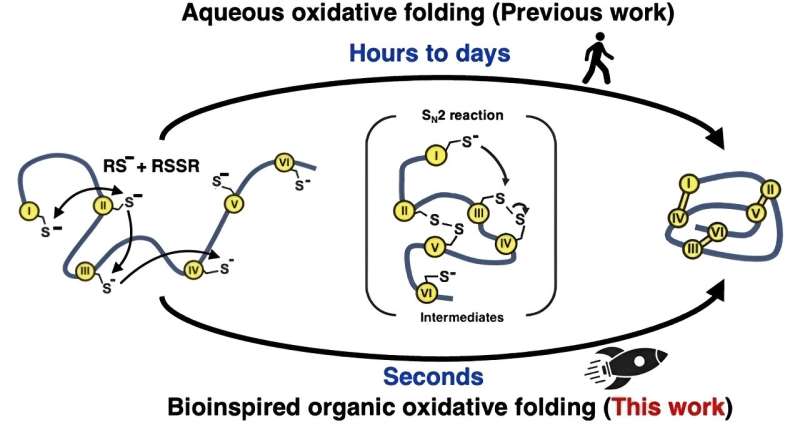
Inspirerade av hur naturen snabbt viker proteiner inuti celler, försökte forskarna ett annat tillvägagångssätt för de "oxidativa" veckningsreaktionerna som bildar disulfidbindningarna. Istället för att använda vattenbaserade (vattenhaltiga) lösningar använde man en blandning av organiska lösningsmedel. Denna metod imiterar det naturliga enzymet som förmedlar disulfidbindningsbildningen, genom att skapa en mycket reaktiv miljö för att kraftigt påskynda bildningen och omarrangemanget av dessa bindningar.
Genom att lära av naturen på detta sätt kunde teamet göra 15 olika peptider och mikroproteiner, mellan 14 och 58 aminosyror långa med två till fem disulfidbindningar, i takter som är mer än 100 000 gånger snabbare än vad som kunde uppnås i vattenhaltiga lösningsmedel.
"Vikningen slutfördes effektivt inom en sekund", säger Dr. Loo, "Och utbudet av mikroproteiner som vi producerade visar att vår metod borde vara effektiv med ett mycket större utbud av peptider och mikroproteiner i framtida undersökningar."
Denna upptäckt är det senaste framstegen från forskningsgruppen XPad (XJTLU Peptide and Drug), gemensamt etablerad av Dr. Loo och Dr. Kam. Denna grupp har åtagit sig att använda verktyg från kemisk biologi, syntetisk biologi och molekylär farmakologi för att främja tillämpningen av peptider för att utveckla terapeutiska medel.
"Framtiden för peptidforskning lovar mycket, och vi är fast beslutna att leverera ännu mer värdefulla framsteg inom detta område", avslutar Dr. Kam.
Mer information: Antony Kam et al, Ultrafast Biomimetic Oxidative Folding of Cysteine-rich Peptides and Microproteins in Organic Solvents, Angewandte Chemie International Edition (2024). DOI:10.1002/anie.202317789
Journalinformation: Angewandte Chemie , Angewandte Chemie International Edition
Tillhandahålls av Xi'an jiaotong-Liverpool University