Forskare från Tokyo Metropolitan University har konstruerat ett nytt mikrototalanalyssystem som kvantifierar en målkemikalie i ett mikrofluidchip utan pumpar, rör och dyra detektorer. Föreningen reagerar med andra kemikalier för att producera en gas och trycker bläck i en ansluten kammare längs en kanal. Inbyggda ljusdetektorer hjälper till att mäta flödeshastigheten, vilket möjliggör mätning av den ursprungliga kemikalien. Den nya enhetens portabilitet möjliggör kvantitativ klinisk analys vid sängkanten.
Microfluidics är en revolutionerande teknik som levererar precisionskemi med mycket färre kemikalier. Genom att etsa tunna kanaler och kammare till ett kompakt chip som får plats i din handflata, kan kemin göras med mikroliters mängder vätska i en enormt parallell uppsättning reaktionsförhållanden, vilket sparar tid, kostnader och miljö.
På senare tid har kvantitativ detektering av kemikalier också införlivats i dessa miniatyranordningar. Dessa mikro-totalanalyssystem (mikro-TAS) lovar en komplett kemisk analys som utnyttjar alla fördelar med mikrofluidik.
Men för att driva flödet runt kanaler och kammare kräver mikrofluidik pumpar, rör för att koppla flödet in i kanaler, samt dyra ljuskällor och detektorer för att direkt mäta de optiska signalerna som berättar hur mycket av olika kemikalier som finns i våra kanaler. Detta gör en metod baserad på miniatyrisering och portabilitet mycket mindre användbar än vad som ursprungligen föreslagits.
Men nu har ett team under ledning av docent Hizuru Nakajima från Tokyo Metropolitan University kommit på en helt ny kvantifieringsmetod som kan bli av med den extra hårdvaran helt och hållet. Studien är publicerad i tidskriften Microchimica Acta .
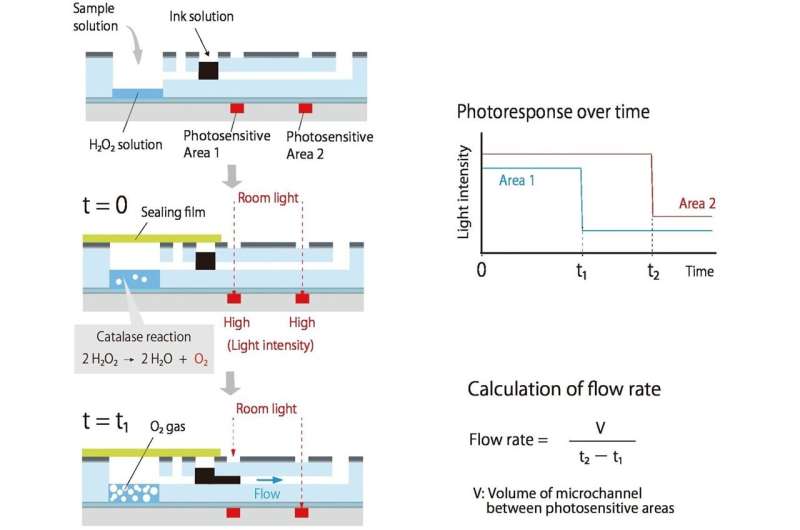
De kom på ett system där någon förening av intresse (analyt) producerar en gas; ju mer analyt det finns, desto snabbare produceras gasen. Detta övertryck hjälper till att driva bläck längs en ansluten kanal.
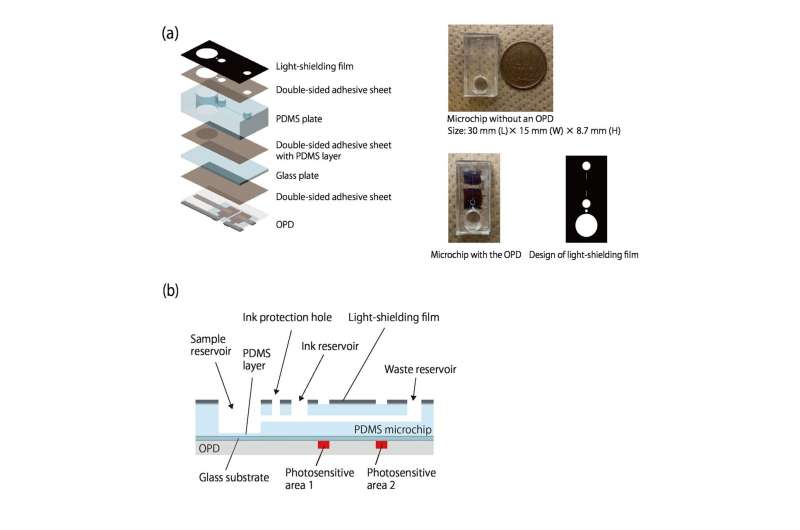
När bläcket flödar längs, blockerar det rumsljus från att nå två organiska fotodetektorer (OPD) som är tryckta längs kanalen, vilket hjälper till att mäta flödeshastigheten. Eftersom ljuset bara behöver blockeras av ett mörkt bläck, är detektionen som krävs billig och enkel. Eftersom flödet drivs av gasproduktion finns det inga pumpar och inga rör.
De demonstrerade sitt system genom att mäta mängden C-reaktivt protein (CRP), ett protein associerat med ett immunsystemsvar.
Först tillsätts en CRP-innehållande lösning till en liten kammare; ju mer CRP det finns, desto mer fäster man vid de specialbehandlade väggarna i kammaren. Nanopartiklar belagda med CRP-antikroppar och katalas tillsätts sedan; ju mer CRP det finns, desto fler nanopartiklar och katalas finns kvar på väggarna. När väteperoxid tillsätts hjälper katalaset till att producera syre och fullbordar slingan mellan analyten (i det här fallet CRP) och bläckflödet.
Teamet visade att CRP-koncentrationen i humant serum kunde detekteras exakt, även i närvaro av vanliga proteiner som immunglobulin G (IgG) och humant serumalbumin.
Det var också bra överensstämmelse med allmänt tillgängliga, mycket mer hårdvaruintensiva metoder. Med tanke på att teamets nya chip är lätt att bära, tror de att det kommer att se mer tillämpning av mikro-TAS i klinisk diagnos vid sängkanten eller miljöanalys i fält.
Mer information: Kuizhi Qu et al, Utveckling av en C-reaktivt proteinkvantifieringsmetod baserad på flödeshastighetsmätning av en bläcklösning som trycks ut av syrgas genererad av katalasreaktion, Microchimica Acta (2023). DOI:10.1007/s00604-023-06108-z
Tillhandahålls av Tokyo Metropolitan University