En forskargrupp från Institutionen för kemi vid Universität Hamburg har för första gången lyckats identifiera på molekylär nivå den dynamiska mekanismen som används av enzymet RNase R för att bryta ned den ribosomala 30S-subenheten. Resultaten av studien publicerades i den vetenskapliga tidskriften Nature .
Proteinsyntes är en livsviktig och energikrävande process i cellen där ribosomer spelar en avgörande roll. Dessa jämförelsevis stora molekyler finns i alla levande organismer och fungerar som cellens "proteinfabriker."
För att göra detta läser ribosomer ritningen för ett specifikt protein på en budbärarmolekyl – budbärar-RNA (mRNA) – och omvandlar sedan denna information till ett nytt protein. Ribosomer består av två underenheter. Den lilla subenheten är ansvarig för att läsa och kontrollera mRNA för fel, medan den stora subenheten ansvarar för polymeriseringen av aminosyror för att bilda proteiner.
Kontrollerad produktion och reglerad omsättning av ribosomer krävs för proteinsyntes. Även om sammansättningen av ribosomer har blivit allt bättre förstådd under de senaste åren, har det inte funnits någon strukturell insikt i nedbrytningen av ribosomer.
Detta är viktigt eftersom celler i stresssituationer som brist på mat eller i slutet av tillväxtcykeln minskar sin ämnesomsättning för att överleva längre. Detta tillstånd är känt som den stationära fasen. Under denna fas reduceras energikrävande proteinsyntes, och vissa ribosomer bryts ned för att frigöra den energi som investeras i dem för att säkerställa cellöverlevnad.
För sina undersökningar studerade forskarna Bacillus subtilis, en stavformad jordbakterie som finns i luft, damm och vatten samt i tarmarna hos människor och djur. "Till skillnad från tidigare studier tog vi celler som fortfarande växte och inte var i den stationära fasen. Vi ville veta vilka processer som äger rum vid övergången till den stationära fasen", säger doktor Helge Paternoga från Kemiska institutionen vid Universität Hamburg, sista författare till studien.
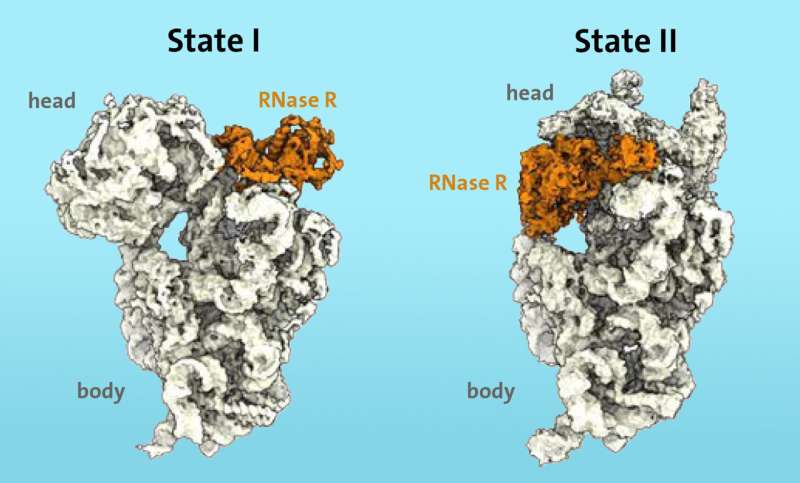
Forskarna visste från tidigare arbete att vissa enzymer, såsom ribonukleas R (RNase R), är involverade i nedbrytningsprocessen av ribosomer i stresssituationer. Med hjälp av kryo-elektronmikroskopi kunde de för första gången visa att enzymet RNase R binder till den lilla 30S-subenheten i ribosomen. "S" står för "Svedberg-enheter" och hänvisar till massan av den ribosomala subenheten.
RNase R skär inte godtyckligt av 30S-underenheten, utan fäster sig snarare på ett fritt område, som forskarna kallar "halsen", och sedan lossar "huvudet", det övre området av underenheten, i två på varandra följande steg.
"I det första steget stöter enzymet RNase R på ett hinder vid "halsen" och destabiliserar halsområdet, vilket gör det mer flexibelt. I det andra steget vänds "huvudet" vilket tar bort hindret och låter enzymet fortsätt nedbrytningsprocessen av 30S-subenheten obehindrat", förklarar Paternoga.
"Våra in vitro-nedbrytningsexperiment indikerar att "huvud"-omkopplaren är en betydande kinetisk barriär för RNase R. Dessutom kunde vi visa att enzymet ensamt är tillräckligt för att genomföra den fullständiga 30S-nedbrytningsprocessen", säger Prof. Dr. Daniel Wilson, chef för forskargruppen vid Institutionen för kemi vid Universität Hamburg och medförfattare till studien.
Mer information: Lyudmila Dimitrova-Paternoga et al, Strukturell grund för ribosomal 30S-subenhetsnedbrytning av RNase R, Nature (2024). DOI:10.1038/s41586-024-07027-6
Tillhandahålls av University of Hamburg