Forskare vid Kanazawa University rapporterar i Journal of Physical Chemistry Letters höghastighets atomkraftmikroskopistudier som belyser den möjliga rollen av proteinet med öppen läsram 6 (ORF6) i COVID-19-symptom.
Medan många länder över hela världen upplever en uppskov från den intensiva spridningen av SARS-CoV-2-infektioner som ledde till tragiska sjukdomsnivåer och flera nationella låsningar i början av decenniet, kvarstår fall av infektion.
En bättre förståelse för mekanismerna som upprätthåller viruset i kroppen kan hjälpa till att hitta mer effektiva behandlingar mot sjukdomar orsakade av sjukdomen, samt beväpna sig mot framtida utbrott av liknande infektioner. Med detta i åtanke har det funnits ett stort intresse för de tillbehörsproteiner som viruset producerar för att hjälpa det frodas i kroppen.
"I likhet med andra virus uttrycker SARS-CoV-2 en rad tillbehörsproteiner för att omprogrammera värdmiljön för att gynna dess replikering och överlevnad", förklarar Richard Wong vid Kanazawa University och Noritaka Nishida vid Chiba University och deras kollegor i detta senaste Rapportera. Bland dessa tillbehörsproteiner finns ORF6.
Tidigare studier har föreslagit att ORF6 stör funktionen av interferon 1 (IFN-I), en speciell typ av litet protein som används i immunsystemet, vilket kan förklara fallen av asymtomatisk infektion med SARS-CoV2. Det finns också bevis för att ORF6 orsakar kvarhållande av vissa proteiner i cytoplasman samtidigt som det stör mRNA-transporten från cellen, vilket kan vara ett sätt att hämma IFN-I-signalering. Mekanismen för denna proteinretention och transportstörning var dock inte klar.
För att belysa dessa mekanismer undersökte forskarna först vilka ledtrådar olika programvaror kan ge om strukturen hos ORF6. Dessa indikerade den sannolika närvaron av flera i sig oordnade regioner. Kärnmagnetisk resonansmätningar bekräftade också närvaron av ett mycket flexibelt oordnat segment.
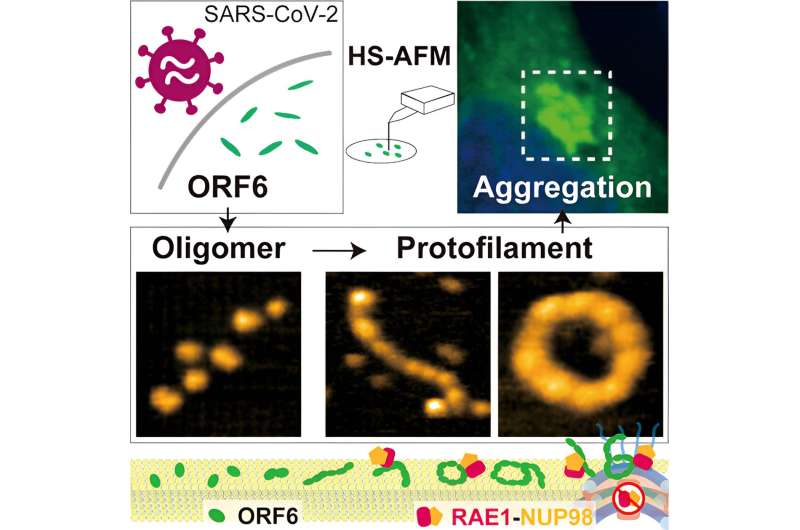
Även om maskininlärningsalgoritmen AlphaFold2 har visat sig vara mycket användbar för att bestämma hur proteiner vikas, begränsar närvaron av dessa i sig oordnade regioner dess användning för att fastställa strukturen för ORF6, så forskarna använde höghastighets atomkraftsmikroskopi (HS-AFM), vilket är kunna identifiera strukturer genom att detektera topografin av prover på det sätt som en skivspelares nål korsar spåren i vinyl.
Med hjälp av HS-AFM fastställde forskarna att ORF 6 främst är i form av ellipsoida filament av oligomerer - strängar av upprepade molekylenheter men kortare än polymerer. Längden och omkretsen av dessa filament var störst vid 37°C och minst vid 4°C, så närvaron av feber kan vara fördelaktig för att producera större filament. Substrat gjorda av lipider – fettföreningar – uppmuntrade också bildningen av större oligomerer.
Eftersom HS-AFM fångar bilder så snabbt var det möjligt att förstå inte bara strukturerna utan också en del av dynamiken i ORF6-beteendet, inklusive cirkulär rörelse, proteinmontering och vändning. Dessutom avslöjade ytterligare datoranalys också att filamenten var benägna att aggregera till amyloider som finns i vissa neurodegenerativa sjukdomar, och vilket kan leda till komplikationer i COVID-19-symtom. Som forskarna påpekar fungerar denna aggregering "för att effektivt binda ett stort antal värdproteiner, särskilt transkriptionsfaktorer involverade i IFN-I-signalering."
Eftersom dessa filament går sönder i närvaro av vissa alkoholer, urea eller natriumdodecylsulfat Wong, drar Nishida och deras kollegor slutsatsen att proteinet till stor del hålls samman av hydrofoba interaktioner. "Möjliga läkemedelskandidater som dissocierar ORF6-aggregat genom att störa hydrofoba interaktioner bör övervägas och testas inom en snar framtid för att utvärdera deras terapeutiska värde vid hantering och behandling av covid-19", säger forskarna.
Mer information: Goro Nishide et al, Nanoscopic Elucidation of Spontaneous Self-Assembly of Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) Open Reading Frame 6 (ORF6) Protein, The Journal of Physical Chemistry Letters (2023). DOI:10.1021/acs.jpclett.3c01440
Journalinformation: Journal of Physical Chemistry Letters
Tillhandahålls av Kanazawa University