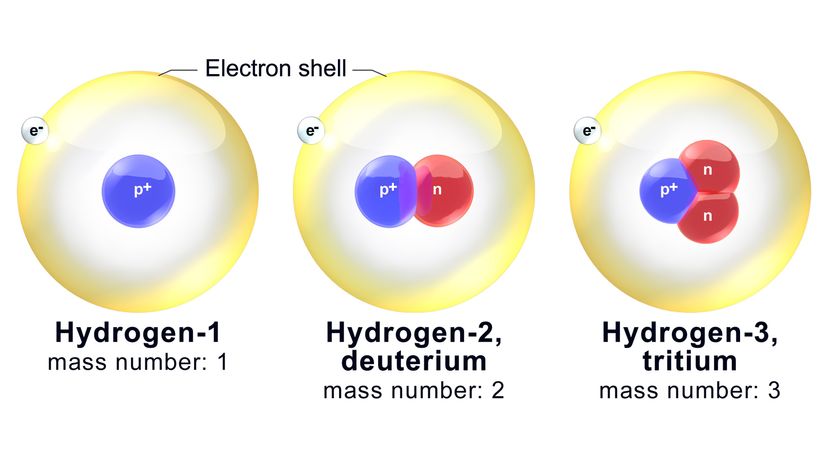
 Varje isotop namnges på grundval av dess massantal, vilket är det totala antalet neutroner och protoner i en atom. Wikimedia Commons
Varje isotop namnges på grundval av dess massantal, vilket är det totala antalet neutroner och protoner i en atom. Wikimedia Commons Atomer är "materiens byggstenar". Allt som har massa och upptar utrymme (genom att ha volym) består av dessa små små enheter. Det gäller luften du andas, vattnet du dricker och din kropp själv.
Isotoper är ett viktigt begrepp i studiet av atomer. Apotek, fysiker och geologer använder dem för att förstå vår värld. Men innan vi kan förklara vad isotoper är - eller varför de är så viktiga - måste vi ta ett steg tillbaka och titta på atomer som helhet.
Som ni säkert vet, atomer har tre huvudkomponenter - varav två finns i kärnan. Beläget i mitten av atomen, kärnan är en tätt packad grupp av partiklar. Några av dessa partiklar är protoner, som har positiva elektriska laddningar.
Det är väl dokumenterat att motsatta avgifter lockar. Under tiden, likadant laddade kroppar tenderar att stöta bort varandra. Så här är en fråga:Hur kan två eller flera protoner - med sina positiva laddningar - samexistera i samma kärna? Borde de inte skjuta iväg varandra?
Det är där neutronerna kommer in. Neutroner är subatomära partiklar som delar kärnor med protoner. Men neutroner har inte en elektrisk laddning. Sann mot deras namn, neutroner är neutrala, varken positivt eller negativt laddat. Det är ett viktigt attribut. På grund av deras neutralitet, neutroner kan stoppa protoner från att driva varandra ur kärnan.
Elektronerna kretsar kring kärnan ultralätta partiklar med negativa laddningar. Elektroner underlättar kemisk bindning - och deras rörelser kan producera en liten sak som kallas elektricitet. Protoner är inte mindre viktiga. För en sak, de hjälper forskare att skilja isär elementen.
Du kanske har märkt att i de flesta versioner av det periodiska systemet, varje ruta har ett litet nummer tryckt i det övre högra hörnet. Den siffran är känd som atomnumret. Det berättar för läsaren hur många protoner som finns i atomkärnan i ett givet element. Till exempel, syres atomnummer är åtta. Varje syreatom i universum har en kärna med exakt åtta protoner; inte mer, inget mindre.
Utan detta mycket specifika arrangemang av partiklar, syre skulle inte vara syre. Varje grundämnes atomnummer - inklusive syre - är helt unikt. Och det är en avgörande egenskap. Inget annat element har åtta protoner per kärna. Genom att räkna protonerna, du kan identifiera en atom. Precis som syreatomer alltid kommer att ha åtta protoner, kväveatomer kommer alltid med sju. Det är så enkelt.
Neutroner följer inte efter. Kärnan i en syreatom kommer garanterat att ha åtta protoner (som vi har fastställt). Dock, den kan också innehålla allt från fyra till 20 neutroner. Isotoper är varianter av samma kemiska element som har olika antal neutroner.
Nu, varje isotop namnges på grundval av dess massantal, vilket är det totala antalet neutroner och protoner i en atom. Till exempel, en av de mer kända syreisotoperna kallas oxygen-18 (O-18). Den har åtta vanliga protoner plus 10 neutroner.
Ergo, massantalet för O-18 är-du gissade det-18. En relaterad isotop, syre-17 (O-17), har en färre neutron i kärnan.
Vissa kombinationer är starkare än andra. Forskare klassificerar O-17 och O-18 som stabila isotoper. I en stabil isotop, krafterna som utövas av protonerna och neutronerna håller varandra ihop, permanent hålla kärnan intakt.
På baksidan, kärnorna i radioaktiva isotoper, även kallad "radioisotoper, "är instabila och kommer att förfalla med tiden. Dessa saker har ett proton-till-neutronförhållande som i grunden är ohållbart i längden. Ingen vill stanna kvar i den knipan. Därför, radioaktiva isotoper kommer att kasta vissa subatomära partiklar (och frigöra energi) tills de har omvandlats till fina, stabila isotoper.
O-18 är stabil, men syre-19 (O-19) är inte det. Det senare kommer oundvikligen att gå sönder - snabbt! Inom 26,88 sekunder efter skapandet, ett prov av O-19 kommer garanterat att förlora hälften av sina atomer till förfallets härjningar.
Det betyder att O-19 har en halveringstid på 26,88 sekunder. En halveringstid är den tid det tar 50 procent av ett isotopprov att förfalla. Kom ihåg detta koncept; Vi kommer att ansluta det till paleontologi i nästa avsnitt.
Men innan vi pratar fossilvetenskap, det är en viktig punkt som måste göras. Till skillnad från syre, vissa element har inga som helst stabila isotoper. Tänk på uran. I den naturliga världen finns det tre isotoper av denna tungmetall, och de är alla radioaktiva, med atomkärnorna i ett konstant förfall. Så småningom, en bit uran kommer att förvandlas till ett helt annat element.
Bry dig inte om att försöka se övergången i realtid. Processen utvecklas mycket, mycket långsamt.
Uran-238 (U-238), elementets vanligaste isotop, har en halveringstid på cirka 4,5 miljarder år! Gradvis, det blir bly-206 (Pb-206), som är stabil. Likaså, uran-235 (U-235)-med sin halveringstid på 704 miljoner år-övergår till bly-207 (Pb-207), en annan stabil isotop.
Till geologer, detta är verkligen användbar information. Låt oss säga att någon hittar en stenplatta vars zirkonkristaller innehåller en blandning av U-235 och Pb-207. Förhållandet mellan dessa två atomer kan hjälpa forskare att bestämma bergets ålder.
Så här gör vi:Låt oss säga att blyatomerna är betydligt fler än deras uran -motsvarigheter. Isåfall, du vet att du tittar på en ganska gammal sten. Trots allt, uranet hade gott om tid att börja förvandla sig till bly. Å andra sidan, om det motsatta är sant - och uranatomerna är vanligare - så måste berget vara på den yngre sidan.
Tekniken vi just har beskrivit kallas radiometrisk dejting. Det är handlingen med att använda de väl dokumenterade sönderfallshastigheterna hos instabila isotoper för att uppskatta åldern på bergprover och geologiska formationer. Paleontologer utnyttjar denna strategi för att avgöra hur lång tid som har gått sedan ett visst fossil deponerades. (Även om det inte alltid är möjligt att datera exemplaret direkt.)
Du behöver inte vara en förhistorisk buff för att uppskatta isotoper. Läkare använder några av de radioaktiva sorterna för att övervaka blodflödet, studera bentillväxt och till och med bekämpa cancer. Radioisotoper har också använts för att ge bönderna inblick i markkvalitet.
Så där har du det. Något så till synes abstrakt som neutronernas variation påverkar allt från cancerbehandling till djuptids mysterier. Vetenskap är häftigt.
NU ÄR DET KULSport och vetenskap korsar vägar oftare än du tror. New Mexicos största stad landade ett nytt baseballlag i mindre liga 2003. Dess namn? Albuquerque -isotoperna. En hänvisning till ett avsnitt 12 av "The Simpsons, "Lagets ovanliga namn har haft en trevlig bieffekt:Av nödvändighet, ballparkanställda delar regelbundet ut kemilektioner till nyfikna fans.