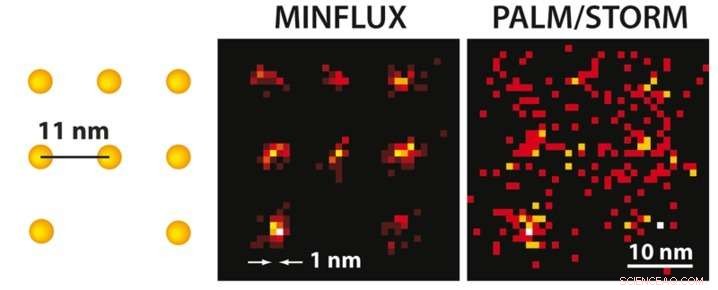
Med MINFLUX mikroskopi kan man, för första gången, separata molekyler optiskt som bara är några nanometer från varandra. Till vänster, ett schema över de fluorescerande molekylerna presenteras. Medan ultrahögupplöst PALM/STORM-mikroskopi vid samma molekylära ljusstyrka (höger) ger en diffus bild av molekylerna (här i en simulering under idealiska tekniska förhållanden), positionen för de enskilda molekylerna kan lätt urskiljas med den praktiskt realiserade MINFLUX (mitten). Upphovsman:MPI f. Biofysisk kemi/ K. Gwosch
Det är ljusmikroskopins heliga gral:att förbättra lösningsförmågan hos denna metod så att man individuellt kan urskilja molekyler som ligger mycket nära varandra. Forskare runt Nobelpristagaren Stefan Hell vid Max Planck Institute for Biophysical Chemistry i Göttingen har nu uppnått det som länge ansågs omöjligt - de har utvecklat ett nytt fluorescensmikroskop, kallas MINFLUX, tillåter, för första gången, att optiskt separera molekyler, som bara är nanometer (en miljonedel av en millimeter) från varandra. Detta mikroskop är mer än 100 gånger skarpare än konventionell ljusmikroskopi och överträffar även de bästa superupplösta ljusmikroskopimetoderna hittills, nämligen STED utvecklat av Hell och PALM/STORM beskrivet av nobelpristagaren Eric Betzig, upp till 20 gånger. För MINFLUX, Helvetet använde fördelarna med STED och PALM/STORM i ett helt nytt koncept. Detta genombrott öppnar nya möjligheter för forskare att undersöka hur livet fungerar på molekylär nivå.
"Vi har rutinmässigt uppnått upplösningar av en nanometer med MINFLUX, som är diametern på enskilda molekyler – den yttersta gränsen för vad som är möjligt inom fluorescensmikroskopi, "förklarar helvetet, Direktör vid Max Planck Institute for Biophysical Chemistry. "Jag är övertygad om att MINFLUX -mikroskop har potential att bli ett av de mest grundläggande verktygen för cellbiologi. Med detta koncept blir det möjligt att kartlägga celler i molekylär detalj och observera de snabba processerna i deras inre i realtid. Detta kan revolutionera vår kunskap om de molekylära processerna som sker i levande celler. "
Göttingen-fysikern, som också arbetar vid Max Planck Institute for Medical Research och German Cancer Research Center i Heidelberg, har länge varit övertygad om att upplösningen av fluorescensmikroskopi kan ökas ner till dimensionen för enskilda molekyler - med klassisk användning av fokuserat ljus och konventionella linser.
Faktiskt, fysikern Ernst Abbe hade formulerat 1873 att upplösningen av ljusmikroskop är begränsad till hälften av ljusets våglängd, vilket är cirka 200 nanometer. Mer än 100 år senare, denna Abbe -gräns är fortfarande giltig. Dock, Helvetet var det första som visade att denna gräns kan övervinnas med STED -mikroskopi, som han skapade 1994 och etablerade experimentellt fem år senare.
STED samt PALM/STORM, utvecklades några år senare, i praktiken uppnå en separationsskärpa på cirka 20 till 30 nanometer - ungefär tio gånger bättre än Abbe -gränsen. För utvecklingen av dessa ultrahögupplösta ljusmikroskopitekniker, Hell och Betzig tillsammans med William E. Moerner tilldelades 2014 Nobelpriset i kemi.
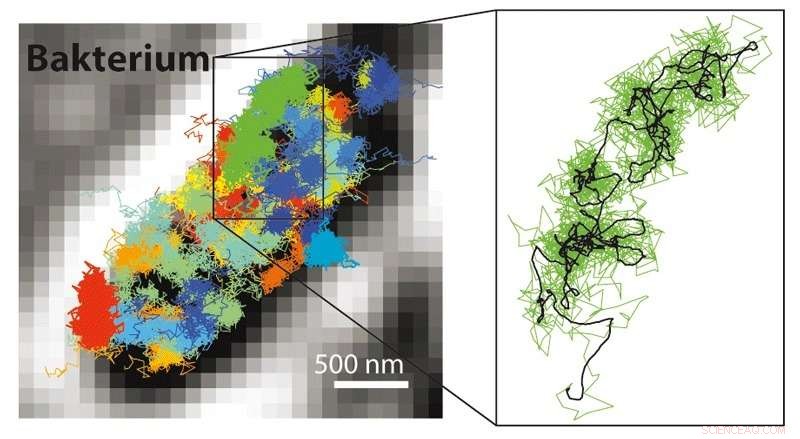
Med MINFLUX är det möjligt att följa många mycket snabbare rörelser än vad som är möjligt med STED eller PALM/STORM mikroskopi. Det är därför möjligt att göra rörelserna av fluorescensmärkta molekyler synliga i en levande cell. Vänster:Rörelsemönster för 30S -ribosomer (delar av proteinfabriker, färgad) i en E. coli-bakterie (svart-vit). Höger:Rörelsemönster för en enda 30S -ribosom (grön) visas förstorad. Upphovsman:MPI f. Biofysisk kemi/ Y. Eilers
Fördelar med STED och PALM/STORM kombinerat
Både STED och PALM/STORM separerar närliggande fluorescerande molekyler genom att slå på och av dem efter varandra så att de avger fluorescens sekventiellt. Dock, metoderna skiljer sig åt i en väsentlig punkt:STED-mikroskopi använder en munkformad laserstråle för att stänga av molekylär fluorescens på en fast plats i provet, d.v.s. överallt i fokusområdet utom vid munkcentret. Fördelen är att munkstrålen definierar exakt vid vilken punkt i rymden motsvarande glödande molekyl är belägen. Nackdelen är att laserstrålen i praktiken inte är tillräckligt stark för att begränsa utsläppet till en enda molekyl vid donutcentret. När det gäller PALM/STORM, å andra sidan, kopplingen till och från sker på slumpmässiga platser och på enmolekylnivå. Fördelen här är att man redan arbetar på enmolekylnivå, men en baksida är att man inte känner till de exakta molekylpositionerna i rymden. Positionerna måste tas fram genom att samla så många fluorescensfoton som möjligt på en kamera; mer än 50, 000 detekterade fotoner behövs för att uppnå en upplösning på mindre än 10 nanometer. I praktiken, man kan därför inte rutinmässigt uppnå molekylär upplösning (en nanometer).
Helvetet hade idén att på ett unikt sätt kombinera båda metodernas styrkor i ett nytt koncept. "Denna uppgift var allt annat än trivial. Men mina medarbetare Francisco Balzarotti, Yvan Eilers, och Klaus Gwosch har gjort ett underbart jobb med att genomföra denna idé experimentellt med mig. "Deras nya teknik, kallas MINFLUX (MINIMAL emission FLUXes), introduceras nu av Hell tillsammans med de tre yngre forskarna som första författare i Science.
MINFLUX, som PALM/STORM, slår på och stänger av enskilda molekyler slumpmässigt. Dock, på samma gång, deras exakta positioner bestäms med en munkformad laserstråle som i STED. I motsats till STED, munkstrålen här väcker fluorescensen. Om molekylen är på ringen, det kommer att lysa; om det är exakt i det mörka centrumet, det kommer inte att lysa men man har hittat sin exakta position. Balzarotti utvecklade en smart algoritm så att denna position kunde lokaliseras mycket snabbt och med hög precision. "Med denna algoritm var det möjligt att utnyttja potentialen för donut -excitationsstrålen, "förklarar den unge forskaren. Gwosch, som erhöll de molekylärt upplösta bilderna, tillägger "Det var en otrolig känsla när vi, för första gången, kunde skilja detaljer med MINFLUX på skalan på några nanometer. "
100 gånger bättre upplösning
Förutom den molekylära upplösningen, kombinationen av STED och PALM/STORM ger en ytterligare stor fördel:"MINFLUX är mycket snabbare i jämförelse. Eftersom det fungerar med en munklaserstråle, det kräver mycket lägre ljussignal, dvs färre fluorescensfotoner, per molekyl jämfört med PALM/STORM för att uppnå den ultimata upplösningen, "Helvetet säger. Redan med STED kunde man spela in videor i realtid från insidan av levande celler. Men nu var det möjligt att spåra molekylernas rörelse i en cell med en 100 gånger bättre tidsupplösning, som Eilers framhåller. Han lyckades filma molekylernas rörelse i en levande E. coli -bakterie med MINFLUX för första gången, med en oöverträffad rumstidsupplösning. "När det gäller hastighet, vi har inte utnyttjat möjligheterna på bästa sätt med MINFLUX, "Säger Eilers. Forskarna är övertygade om att även extremt snabbt förekommande förändringar i levande celler kan undersökas i framtiden, som till exempel rörelsen av cellulära nanomaskiner eller vikning av proteiner.