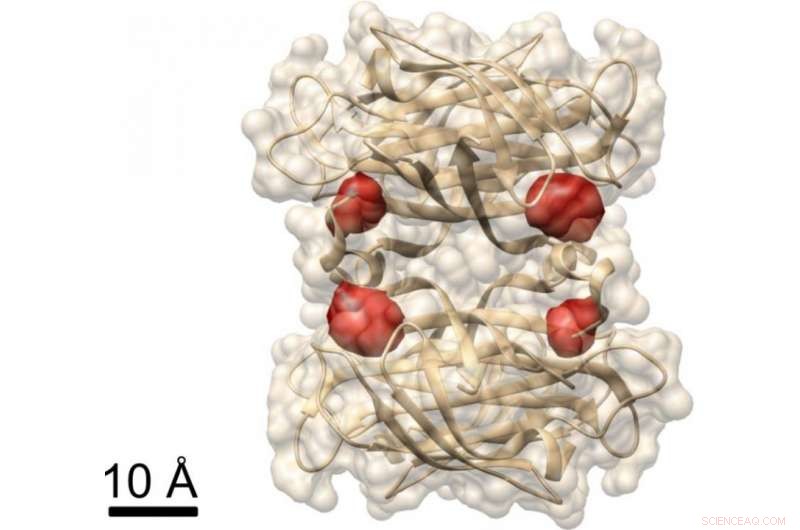
Visning av ett protein:Max Planck -forskare har använt COLD -metoden för att visualisera de fyra bindningsställena för biotin (märkt med röda färgämnen) i proteinet streptavidin, vars struktur redan är känd. Kredit:MPI för Science of Light
Ljusmikroskopi fortsätter att avslöja den mikroskopiska världen med en allt större upplösning. Med hjälp av en ny metod myntad KALL, forskare vid Max Planck Institute for the Science of Light i Erlangen har nu visualiserat proteinstrukturer med en upplösning på cirka 5 Å. COLD uppnår denna oöverträffade upplösning genom att arbeta vid en temperatur på minus 270 grader Celsius. Vid så låga temperaturer, signalerna från fluorescerande proteiner kan lokaliseras mer exakt. Metoden öppnar därmed möjligheten låga temperaturer, signalerna från fluorescerande proteiner kan lokaliseras mer exakt. Metoden öppnar därmed möjligheten att observera strukturella förändringar av proteiner associerade med specifika sjukdomar.
Fram till slutet av 1900 -talet, ljusmikroskop var föremål för en stor begränsning:deras upplösning begränsades av ljusets vågkaraktär. Redan 1873, fysikern Ernst Abbe formulerade en lag som, i förenklade termer, säger att ett optiskt mikroskop inte kan lösa strukturer som mäter mindre än halva våglängden för synligt ljus - cirka 200 nanometer. "Detta motsvarar en kedja med flera tusen atomer, "förklarar Vahid Sandoghdar, Direktör vid Max Planck Institute for the Science of Light.
Denna gräns ansågs vara oöverstiglig-tills forskare utvecklat fluorescensmikroskopimetoder med superupplösning, som STED och PALM / STORM, under de senaste två decennierna. Dessa tekniker förbättrade den optiska upplösningen till cirka 20 till 30 nanometer. Under 2014, forskarna som är involverade i dessa uppfinningar, inklusive Stefan Hell vid Max Planck Institute for Biophysical Chemistry i Göttingen, fick Nobelpriset i kemi. Nyligen, ett team som leds av Hell ökade upplösningsgränsen med ytterligare tjugo gånger med hjälp av en nyutvecklad mikroskopiteknik som kallas MINFLUX. Upplösningen av denna metod var tillräcklig för att skilja angränsande molekyler som bara är några nanometer från varandra.
COLD tillåter en inblick i enskilda proteinmolekyler
Vahid Sandoghdar och hans kollegor har arbetat med alternativa metoder för att öka prestandan för högupplöst fluorescensmikroskopi i flera år nu-med stor framgång, som Erlangens fysiker rapporterar:"Vårt nya tillvägagångssätt tillåter oss att visa strukturer som är åtskilda med ett avstånd på mindre än fem ångström, dvs en halv nanometer. Vi kan därför undersöka proteinmolekyler. "Sandoghdar och hans kollegor presenterade grundkonceptet för första gången 2013, som de har skapat COLD för kryogen optisk lokalisering i tre dimensioner. Namnet COLD säger allt:"Det viktigaste med COLD är den låga temperaturen vid vilken mätningarna sker, cirka minus 270 grader Celsius, säger fysikern.
Grundprincipen för fluorescensavbildning är densamma för alla mikroskop:Provet är först kemiskt märkt med fluorescerande molekyler som kallas fluoroforer. Detta gör att vissa områden eller komponenter i provet, t.ex. celler, synlig. Dock, konventionella tekniker begränsas av Abbe -gränsen. När flera fluoroforer på nära håll avger ljus samtidigt deras signaler överlappar varandra och kan inte längre kännas igen som separata punkter. Superupplösningsmetoderna, däremot, kan slå på och av fluorescerande fläckmolekyler. Detta gör det möjligt att bestämma positionen för var och en med en relativt hög precision. Dock, precisionen lider av statistiskt brus:desto kortare avger fluoroforerna ljus, ju större oriktighet. Och vanligtvis tänds de bara under mycket kort tid, eftersom ljusinducerade kemiska processer bleker molekylen.
Molekyler kan lokaliseras mer exakt vid låga temperaturer
Det är här COLD spelar in. De extremt låga temperaturerna bromsar fotoblekningen enormt så att varje fluorofor tänds under betydligt längre tid. "Detta minskar brus på bilderna och förbättrar lokaliseringsnoggrannheten, "säger Siegfried Weisenburger, som utförde experimenten som en del av sin doktorandforskning vid Sandoghdars institution.
I samarbete med Christian Griesinger och hans avdelning vid Max Planck Institute for Biophysical Chemistry i Göttingen, Erlangens forskare kunde använda sin teknik för att lösa två fluoroforer på ett protein som bara var en nanometer från varandra. I denna skala, även de minsta vibrationer och rörelser i provet kommer att förstöra experimentet. "För att mäta avstånd i atomskala, vi var tvungna att utveckla en speciell, extremt stabilt kryogent mikroskop, "Sandoghdar förklarar." Proverna bereds genom att fördela proteinerna i en tunn polymerfilm på en glasskiva. "
Hur ordnas proteiner i ett membran?
I ett annat experiment, forskarna visade att COLD kan användas för att bestämma den rumsliga strukturen hos proteiner:De märkte ett protein som heter streptavidin på fyra specifika platser med fluoroforer och tog flera hundra bilder. De rekonstruerade sedan proteinets struktur med hjälp av tomografialgoritmer. I sista hand, de uppnådde en tredimensionell upplösning på ungefär en halv nanometer för att lokalisera de fyra färgämnen. "Denna resolution tillåter strukturstudier vid gränsen för andra metoder inom strukturbiologi." Detta gäller särskilt för Christian Griesingers forskningsområde, NMR -spektroskopi, som bara kan lösa avstånd under fem ångström. "COLD överbryggar klyftan mellan fluorescensmikroskopi och strukturbiologi, "säger Max Planck -direktören i Göttingen.
Resultaten är mycket relevanta för ett antal forskare. "I celler, proteiner ändrar sin struktur för att utföra eller ändra sina funktioner. Dessutom, specifika strukturförändringar är ofta förknippade med specifika sjukdomar, "säger Sandoghdar. Dessutom har COLD kan bestämma orienteringen av proteiner. "Orientering är särskilt intressant när du tittar med proteiner i ett membran. Det är föremålet för våra nuvarande experiment, "förklarar Daniel Böning, medlem i forskargruppen i Erlangen.
Sandoghdar räknar med att upplösningen av COLD kan förbättras ytterligare med en faktor tio. Tekniken skulle sedan fungera på atomnivå. Dock, i så fall skulle det komma emot den inneboende gränsen för fluorescensmikroskopi till följd av storleken på de använda etikettmolekylerna. "COLD är perfekt för att visualisera proteiner eller mindre aggregat av biomolekyler. Å andra sidan, på grund av de ogästvänliga temperaturerna, tekniken kan inte användas för att undersöka processer i levande celler, "Sandoghdar sammanfattar." För tillfället, ingen mikroskopimetod kan observera allt. De olika strategierna måste därför fortsätta att användas - som tidigare och under överskådlig framtid - på ett kompletterande sätt. "