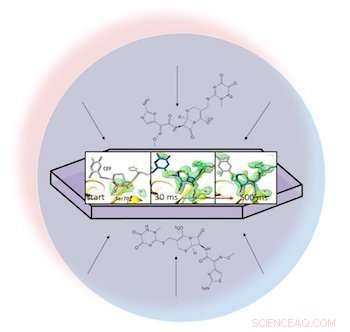
I en vätskedroppe (representerad av den ljusblå cirkeln), ett antibiotikum sprids genom ett kristalliserat protein, beta-laktamas, och binder till det. Röntgenbilder av det bundna paret gjorde det möjligt för forskare att skapa kartor över elektrontätheten (grön) och se hur en ring i antibiotikan bryts upp (längst till höger) 30 till 500 millisekunder efter att reaktionen började. Kredit:Marius Schmidt/ University of Wisconsin Milwaukee
Rice University-forskare använde en snabbt pulserande röntgenlaser för att visa hur läkemedelsresistenta tuberkulosbakterier inaktiverar de antibiotikamolekyler som är avsedda att behandla den dödliga lungsjukdomen.
Risbiokemisten George Phillips och doktorand och medförfattare Jose Olmos är en del av National Science Foundation-stödda BioXFEL Center som fångade de banbrytande proof-of-principal-resultaten genom en teknik som kallas mix-and-inject seriell kristallografi.
För att göra det krävdes användning av ett nytt verktyg, en röntgenfri elektronlaser (XFEL) som lovar en seriös uppgradering av den mödosamma, hundraårig process för att karakterisera molekyler genom röntgenspektroskopi. Lasern är placerad vid Department of Energys SLAC National Accelerator Laboratory vid Stanford University.
Att definiera molekylära strukturer är nyckeln till att förstå hur de fungerar, sa Phillips. Den nya upptäckten visar forskarnas snabbt växande förmåga att ta ögonblicksbilder av dynamiska biologiska processer när de inträffar.
Trogen sitt namn, mix-and-inject-tekniken matar en smal ström av kristalliserade molekyler i en lösning till lasern. När lasern träffar en kristall med en puls på 20 femtosekunder (kvadrilliondels sekund) den utplånar kristallen – men inte innan den producerar ett diffraktionsmönster på en detektor som visar molekylens atomstruktur.
I en öppen uppsats i BMC Biology, forskarna ledda av Marius Schmidt, professor vid University of Wisconsin-Milwaukee, beskrev blandning av antibiotikumet ceftriaxon med ett resistent enzym som används av bakterier, beta-laktamas, och matar den till den pulserande lasern. Eftersom de kunde justera tiden mellan blandning och ankomst till lasern, de fångade diffraktionsmönster för de kristalliserade molekylerna inte bara i slumpmässiga orienteringar utan också i flera stadier av interaktion.
"Medan det har gjorts eleganta studier för att observera proteinrörelser med ljusinducerade förändringar, vårt arbete visar att en större klass av proteiner, nämligen enzymer, kan undersökas på ett tidsbestämt sätt vid LCLS (Linac Coherent Light Source) och andra XFELs, sa Olmos.
Phillips sa att experimentet bevisade XFEL:s användbarhet för att fånga diffraktionsmönster från kristaller en miljondels meter tvärs över eller mindre, mycket mindre än tidigare tekniker. "Detta kommer att lära oss mer om hur naturen har valt ut och designat dessa molekyler för att fungera, " sa han. "Det är inte olikt att se en cykel trampas:Du får mer än en statisk bild och en bättre förståelse för hur det fungerar.
"När du vill konstruera ett protein eller återskapa en molekylär maskin, att veta mer om hur de fungerar på en grundläggande nivå kommer att vara till hjälp, oavsett om det handlar om att bryta ner cellulosa för biobränslen eller att designa ett nytt läkemedel eller att förbättra ett befintligt läkemedel."
I sina presentationer, Phillips jämför förmågan att ta ögonblicksbilder av proteiner i aktion med 1800-talsbilder av Eadweard Muybridge som fångade en galopperande hästs mittgående rörelse. (Av en slump, hästen ägdes av Stanfords grundare.)
Forskarna förväntar sig den snart uppgraderade XFEL på Stanford, en ny anläggning i Europa och andra på gång runt om i världen kommer att göra det möjligt för forskare att fånga strukturer på minuter snarare än dagar och ge dem mer detaljerad information om kemiska processer.
Phillips har stora förhoppningar att de uppgraderade verktygen också kommer att hjälpa till att fånga strukturerna hos molekyler utan att behöva kristallisera dem först.
"Om vi kan få röntgenstrålen och bakgrundsspridningen tillräckligt liten och avläsningsstrålen tillräckligt ren, då i teorin, istället för att paradera kristaller, vi kan paradera in enstaka molekyler i lasern för att bygga upp diffraktionsmönster, " han sa.
"Stanford-lasern avfyrar just nu med 100 hertz (cykler per sekund), " sade Phillips. "Europeiska XFEL kommer att skjuta vid 10, 000 hertz. Det är en ganska uppgradering eftersom det ger oss mycket fler chanser att träffa molekylerna när de strömmar in."
Han sa att centret i slutändan hoppas kunna fånga strukturella data för molekylära reaktioner i farten.
"Det kan vara två proteiner som går ihop och lär sig känna igen varandra, det kan vara interaktionen mellan ett virus och en antikropp, det kan vara interaktionen av något substrat med ett enzym eller något du kan göra genom att blanda eller med extern stimulering, " sa Phillips. "När du kan göra det, himlen är gränsen."