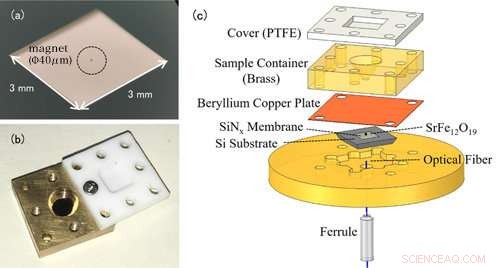
Figur 1:(a) Foto av ett nanomembran. Själva nanomembranet är mycket tunt (100 nm) så det verkar genomskinligt för blotta ögat. Objektet inringat i mitten är en liten magnet för EPR-detektering. (b) Foto av lösningscellen. Behållaren toppas med ett teflonlock för att förhindra att lösningsprovet avdunstar. (c) Den experimentella uppställningen av den kraftdetekterade EPR-spektroskopin. Lösningscellen som innehåller mätprovet placeras ovanför membranet med magneter fästa. Förändringar i nanomembranen detekteras av den optiska fibern under membranet. Upphovsman:Kobe University
Forskare har utvecklat en ny metod för att analysera metalloproteiner med bara ett litet flytande prov. Detta genombrott uppnåddes av ett forskargrupp som leds av docent Eiji Ohmichi och Tsubasa Okamoto vid Kobe University Graduate School of Science. Resultaten publicerades den 28 november i Bokstäver i tillämpad fysik .
Metalloproteiner (även kända som metallbindande proteiner) spelar viktiga roller för syretransport och lagring, elektrontransport, oxidation och reduktion. I många fall, metalljonerna i dessa proteiner är de aktiva centra för dessa aktiviteter, så genom att identifiera det exakta tillståndet för dessa joner, vi kan förstå mekanismerna bakom deras funktioner.
En experimentell metod som kallas elektronparamagnetisk resonans (EPR) kan användas för att mäta tillståndet för elektronjoner i proteiner. Effektiv EPR -teknik kräver en viss mängd provvolym för känsliga mätningar. Dock, många metalloproteiner är svåra att isolera och förädla, så forskare kan bara få små prover.
Konventionella EPR -mätningar detekterar de elektromagnetiska vågor som absorberas av metalljoner. Den anmärkningsvärda egenskapen i denna studie är användningen av en trampolinformad enhet som kallas en nanomembran (figur 1 (a)). I EPR, elektronspinningen övergår till ett högenergitillstånd genom att absorbera elektromagnetiska vågor, men samtidigt, snurrriktningen vänder, och metalljonernas magnetiska egenskaper förändras också. Innan experimentet, forskargruppen fäst små magneter på nanomembranen, så förändringarna i attraktionskraften mellan magneterna och metalljonerna förvandlas till en kraft på nanomembranen, och denna EPR -signal detekteras. Eftersom nanomembranen är mycket tunn - bara 100 nm (=0,1 μm) kan vi känsligt mäta små förändringar i kraft som följer med EPR -absorption.
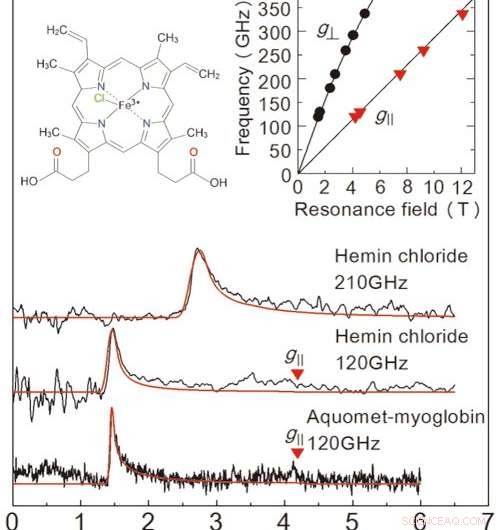
Figur 2:Resultat av EPR-mätningarna erhållna i denna studie från ett fruset lösningsprov. De två översta diagrammen är för heminklorid, och grafen längst ner är för myoglobin. Den röda linjen är en projicerad signal från en värdesimulator. Lösningskoncentrationerna och provvolymerna var 50 mM、2 μL för heminklorid, och 8,8 mM 、 10 μL för myoglobin. Mätningar utfördes vid 4,2 K. Genom att undersöka de två raderna i grafen uppe till höger kan vi bestämma det exakta tillståndet för järnjoner. Den övre vänstra grafen visar heminklorids molekylära struktur. Upphovsman:Kobe University
Lösningsprovet placeras i en lösningscell direkt ovanför membranet (figur 1 (b)). Cellvolymen är bara 50μL (=0,05 cc), och teamet lägger till cirka 1-10μL (0,001-0,01 cc) lösning för mätning. För att förhindra att lösningen avdunstar, cellen är täckt med ett hartslock. I denna metod är den tunna och ömtåliga nanomembranen oberoende av lösningscellen, gör det enkelt att byta prover (figur 1 (c)).
För att utvärdera prestandan för denna installation, laget utförde EPR-mätning över en högfrekvent (över 0,1 THz) för ett järninnehållande protein som kallas myoglobin och dess modellkomplex heminklorid (figur 2). Teamet lyckades upptäcka EPR-signaler över en bred vågfrekvens (0,1-0,35 THz) för en 50 mM koncentration, 2μL heminkloridlösning. De observerade också en karakteristisk EPR -signal för en 8,8 mM, 10μL prov av myoglobinlösning. En stor fördel med denna metod är förmågan att mäta över ett brett frekvensområde, gör den tillämplig för metalloproteiner med en mängd olika magnetiska egenskaper.
Professor Ohmichi kommenterar:"Den här nya metoden gör det möjligt att på en detaljerad nivå fastställa metalljonernas tillstånd i en liten mängd metalloproteinlösning. Vi kanske kan tillämpa metoden på metalloproteiner som tidigare inte kunde mätas. Till exempel , i våra ämnesomsättningar, ett metalloprotein som kallas peroxidas spelar en avgörande roll genom att omvandla väteperoxid till vatten, gör det ofarligt, men detaljerna i mekanismen för denna reaktiva process är fortfarande oklara. Resultaten från denna studie kan potentiellt användas som en ledande analysmetod för att belysa denna typ av livsviktiga fenomen."