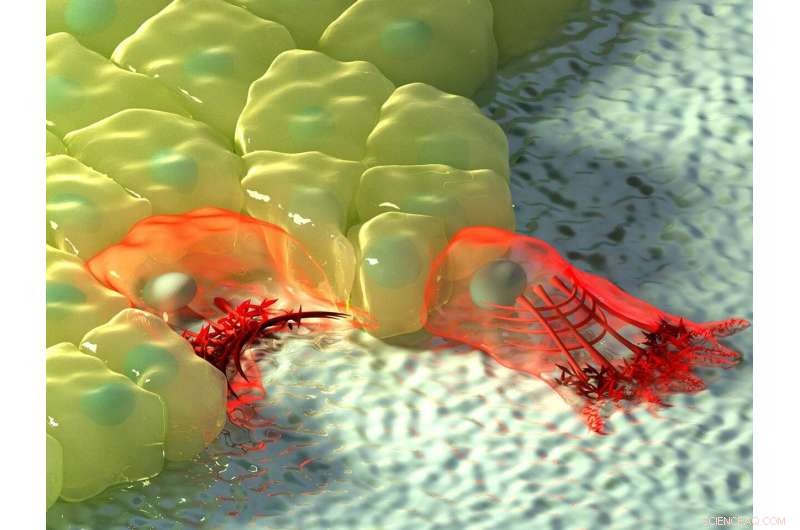
Figuren ovan visar en konstnärlig illustration av celler i områden med negativ (vänster) och positiv krökning (höger). Vid negativ krökning, aktinflödet rör sig mot aktinkabeln vid cellens kant, skildras av ökningen i färgintensitet, och den kontraktila kabeln lyfter kanten ovanför substratet. Vid positiv krökning, lamellipodia sträcker sig från cellen för att krypa längs substratet, och dessa utsprång kännetecknas av retrograd aktinflöde mot cellens insida. Upphovsman:Mechanobiology Institute, National University of Singapore
I svår terräng, terrängfordon kan växla från två- till fyrhjulsdrift för att fortsätta framåt. Liknande, cellmigration kan drivas antingen genom utskjutningsstyrd genomsökning, eller genom kontraktila dragkrafter, men hur cellen växlar mellan dessa två metoder förblir ett mysterium. En samarbetsstudie som leds av MBI -doktoranden Tianchi Chen och professor Benoit Ladoux från Mechanobiology Institute (MBI) vid National University of Singapore, har upptäckt att den riktning i vilken aktinfilament flödar inuti cellen gör att den kan känna den fysiska krökningen i sin omgivning, och detta riktningsflöde är nyckelomkopplaren som bestämmer vilken migreringsmetod som väljs. Verket publicerades i april 2019 -numret av Naturfysik .
Krökning inducerade omorganisation av aktinflöde
Cellmigration är en väsentlig biologisk process som driver vävnads- och organbildning under embryoutveckling, och hjälper också till att skydda kroppen genom immunsvar och sårläkningsmekanismer. Formändringarna som krävs för cellmigration beror på dynamisk organisation och kraftgenerering från cellens inre actomyosin -cytoskelet, som består av strukturella aktinfilament och kontraktila myosinmotorproteiner.
Omorganisation av dessa komponenter möjliggör två mekanismer för cellmigration:tillväxt och förlängning av aktinbaserade lamellipoidala utsprång som gör att cellen kan "krypa" utåt, eller bildandet av stora kontraktila aktomyosinkablar som kan dra cellen framåt samtidigt som de genererar dragkrafter på substratet. Dock, processen genom vilken cellen väljer att bilda utskjutande eller kontraktila kablar förblir oklar.
Beroende på den fysiska miljöens topografi, celler kan stöta på regioner med positiv eller negativ krökning. Positiv krökning hänvisar till en konvex form som böjer utåt, ungefär som en stor bokstav 'D', Ett exempel på motsatt negativ krökning kan ses i bokstaven 'C', som bildar en konkav form som böjer sig inåt. Genom att observera migrering av epitelceller på blomformade substratmönster som används för sårstängningsanalyser, en internationell, tvärvetenskapligt forskargrupp som leds av prof Ladoux i samarbete med MBI:s huvudutredare Docent Boon Chuan Low och docent Yusuke Toyama, tillsammans med teoretiska fysiker och forskare i Frankrike, Chile, Israel och Spanien fann att vid regioner med positiv krökning, celler utvecklade lamellipodia för cellkrypning, och i regioner med negativ krökning, starka aktinkablar monterade som följde den konkava kanten.
Ytterligare observation av aktindynamik i realtid med användning av levande cellmikroskopi avslöjade en skillnad i aktinflödets riktning vid de två krökningarna. Vid positiv krökning inducerad lamellipodia, flödet av aktin var retrograd, dvs bort från cellmembranet i motsatt riktning mot utsprånget. Omvänt, vid negativa krökningar var aktinflödet anterograd, dvs mot cellmembranet där aktinkabeln var belägen.
Detta anterogradeflöde driver sammansättningen av distinkta, polariserade aktinstrukturer vid dessa regioner med negativ krökning. Aktinkabeln vid den konkava kanten är placerad på framsidan, följt av tvärgående aktinfibrer som är orienterade i samma riktning som aktinkabeln, och som tar upp baksidan av nätverket är radiella aktinfibrer orienterade 90 grader mot aktinkabeln. Intressant, bildandet av dessa polariserade aktinstrukturer som svar på negativ krökning observerades i enstaka celler och cellark som vandrade på en 2-D yta, och i celler inbäddade i 3-D fibrösa nätverk. Även om dessa resultat bekräftade förekomsten av två mekanismer för cellmigration, det fanns fortfarande en öppen fråga om hur cellerna kunde känna av krökning av miljön.
Lyckligtvis, levande cellavbildning gav forskarna en potentiell ledtråd - växeln i aktinflödesriktningen beroende på krökning kan potentiellt vara "sensorn" för att byta migrationsläge. Detta bekräftades genom att pläta epitelceller på en mikromönstrad yta belagd med ett vidhäftande substrat, som var prickad med icke-vidhäftande cirkulära lappar. När cellarket stötte på en icke-vidhäftande cirkel, lamellipodiala utsprång kryper runt cirkeln, att dra cellerna framåt på det självhäftande substratet. Detta skapade automatiskt en konkav form över den icke-vidhäftande cirkeln, vilket orsakade en snabb omkoppling i riktningen av actomyosinflödet från retrograd till anterograd, vilket resulterar i montering av en aktinkabel och en switch i migrationsmekanism. Den kontraktila kabeln kan lyfta upp cellens kant över den icke-vidhäftande cirkeln, så att migrering av cellarket kan fortsätta.
Även om celler innehåller krökningssensorer i sitt membran, såsom BAR -proteiner, dessa tillåter endast detektering av krökning på molekylnivå. Väsentligen, storleken på dessa sensorproteiner betyder att de bara kan känna krökning i sin omedelbara närhet i en skala av nanometer, inte på nivån för hela cellen. Dock, denna studie avslöjar hur celler kan känna större krökningsförändringar i cellstorlek i en skala upp till tiotals mikrometer, genom dynamisk anpassning av aktinflödet.
Denna förmåga gör att cellen kan välja en lämplig mekanism för att fortsätta migrering, även när man ställs inför olika förändringar i den fysiska miljön, ungefär som hur ett terrängfordon kan växla mellan två- och fyrhjulsdrift beroende på terräng. Med den nya kunskapen om denna aktinflödesbrytare, forskare kan bättre förstå hur celler kan fortsätta migrera under sårläkning, eller i situationer där migration kan vara skadlig, såsom metastatisk progression av cancer.