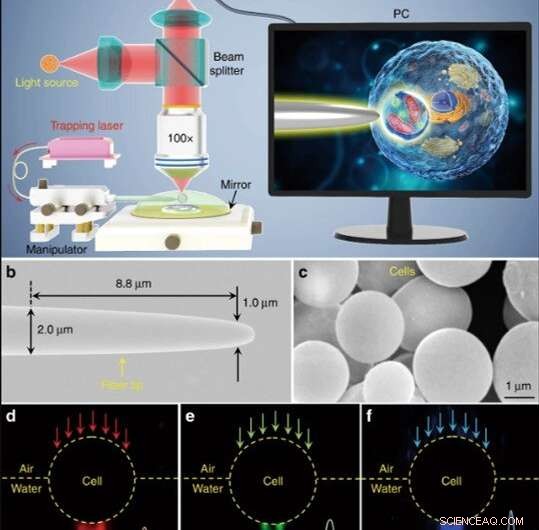
Schematisk illustration och materialkaraktärisering. (a) Schematisk illustration av experimentuppställningen. Ett konventionellt reflektionslägesmikroskop utrustat med en CCD-kamera och ×100 objektiv användes för att observera prover och spela in bilder. Insättningen som visas på en PC-skärm som schematiskt visar hur bioförstoringsapparaten används för att förstora och avbilda de subcellulära strukturerna inuti ett bioprov. (b) SEM-bild av fiberspetsen med en diameter på 1,0 μm vid dess avsmalnande ände. (c) SEM-bild som visar jästcellbaserade bioförstoringsapparater med släta ytor och sfäriska former. d-f mörkfältsbilder som visar 644 nm rött ljus (d), 532-nm grönt ljus (e), och 473 nm blått ljus (f) som sänder genom bioförstoringsapparaten och fokuseras till subvåglängds ljusfläckar med midjeradier på 370, 300, och 270 nm, respektive. Kredit:Light:Science &Applications, doi:10.1038/s41377-019-0168-4
Optiska mikroskop och pincett kan avbilda och manipulera objekt i mikroskala för tillämpningar inom cellulär och molekylärbiologi. Den optiska upplösningen är, dock, hämmas av diffraktionsgränsen och därför kan både mikroskop och pincett inte avbilda och manipulera nanoobjekt direkt. Nya tekniker i plasmoniska/fotoniska nanoskop och nanotweezer syftar till att uppnå upplösning i nanometerskala, även om materialstrukturer med högt index lätt kan orsaka mekanisk och fototermisk skada på bioproverna i nanoskala.
I en nyligen publicerad studie nu publicerad på Ljus:Vetenskap och tillämpningar , Yuchao Li och kollegor vid Institute of Nanophotonics i Kina, utvecklat ett optiskt mikroskopsystem som använder levande celler som små linser för att avbilda och manipulera föremål som är mindre än ljusets våglängd. De visade sub-diffraktionsgränsavbildning och manipulering av nanoobjekt med en icke-invasiv enhet, som de konstruerade genom att fånga en cell på en fiberspets. Den fångade cellen bildade en bioförstoringsapparat som kunde förstora nanostrukturer med en upplösning på 100 nm, under vitljusmikroskopi. Med hjälp av bioförstoringsapparaten, Li et al. bildade en nanooptisk fälla för att exakt manipulera en enskild nanopartikel med en radie på 50 nm. Tekniken ger ett högprecisionsverktyg för optisk avbildning, avkänning och montering av bio-nanomaterial utan mekanisk eller fototermisk skada.
Optisk avbildning för att manipulera små föremål är avgörande för medicinsk diagnos, biologisk avkänning, cellulär utforskning, molekylär träning och materialsammansättning. Pincett och mikroskop är standardenheter för beröringsfri avbildning och manipulering av små prover som sträcker sig från några nanometer till flera mikron. Ändå, det är utmanande att använda tekniken för att ta bilder i nanoskala, eftersom den optiska upplösningen är begränsad till ungefär halva belysningsvåglängden.
Forskare har uppnått dramatiska framsteg med nanoskop och nanotweezer i närområdet under de senaste decennierna för att uppnå optisk avbildning med nanometerupplösning. Dessa avbildningstekniker undanhölls av högindex oorganiska material såsom ädelmetaller och halvledare som används för deras tillverkning - som kan mekaniskt skada prover av biologiska celler eller vävnad under närfältsavbildning och manipulation.
Forskare undersökte därför enklare optiska avbildningsscheman baserade på dielektriska mikrosfärer för att övervinna diffraktionsgränsen som är vanlig för konventionella mikroskop. Även om tekniken är etikettfri och genomförbar, sådana mikrosfärer är baserade på konstgjorda oorganiska material som kiseldioxid (SiO 2 ), titandioxid (TiO 2 ) och bariumtitanat (BaTiO 3 ). Forskare är därför intresserade av att utveckla ett naturligt biomaterial för att konstruera en biokompatibel enhet för bioavbildning, manipulation och biomagnifiering vid rumslig upplösning i nanoskala.
(a) Schematisk illustration av experimentuppställningen. Ett konventionellt reflektionslägesmikroskop utrustat med en CCD-kamera och ×100 objektiv användes för att observera prover och spela in bilder. Insättningen som visas på en PC-skärm som schematiskt visar hur bioförstoringsapparaten används för att förstora och avbilda de subcellulära strukturerna inuti ett bioprov. Kredit:Light:Science &Applications, doi:10.1038/s41377-019-0168-4 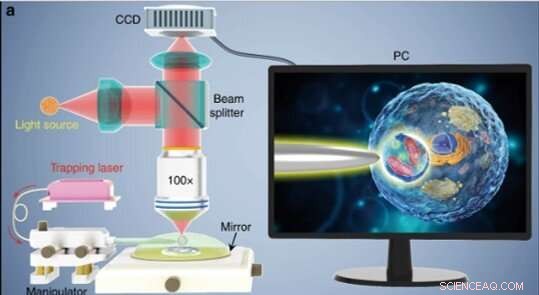
Forskarna genomförde alla experiment under ett optiskt mikroskop i reflektionsläge kopplat till en laddningskopplad enhet (CCD) kamera och objektiv. De använde ljuskällor vid 390 nm, 560 nm och 808 nm för excitation, belysning respektive fångst. Med hjälp av en optisk fiber med en avsmalnande spets, Li et al. fångade bioförstoringsapparaten i änden av fibern, som de kontrollerade genom att flytta spetsen med hjälp av en mikromanipulator. Li et al. valde släta och sfäriska celler för att minimera bildaberration och noterade att cellerna uppvisade bättre fokuseringsprestanda när de halvsänktes i lösning för att bibehålla cellviabiliteten.
Experimentell bildprestanda för olika bioförstoringsapparater. (a) Schematiskt diagram som visar att bioförstoringsapparaten samlar in närfältets nanostrukturer från ett objekt och bildar en praktiskt taget förstorad bild som kan fångas av ett konventionellt optiskt mikroskop. (b–e) Optiska bilder av olika bioförstoringsapparater konstruerade av bakteriell (b), jäst (c), rött blod (d), och stamceller (e) som är delvis nedsänkta i cellsuspension. f SEM-bild av en tvådimensionell hexagonal tätpackad kiseldioxid nanosfäruppsättning sammansatt med en fotoferesteknik. (g–j) Optiska bilder av kiseldioxid nanosfären förstorade genom bioförstoringsapparater baserade på bakteriell (g), jäst (h), rött blod (i), och stamceller (j). (k) SEM-bild av ytan på ett Blu-ray-skivgitter med en linjebredd på 200 nm och ett avstånd på 100 nm. l–o Optiska bilder av Blu-ray-gitterstrukturen förstorad genom bioförstoringsapparater baserade på bakteriell (l), jäst (m), rött blod (n), och stamceller (o). p Intensitetsprofil längs den streckade linjen över Blu-ray-gitterstrukturen som anges i o. q Blå prickar som visar förstoringsfaktorn M för bilderna som erhållits av bioförstoringsapparaterna som en funktion av bioförstoringsglasets diameter. Kredit:Light:Science &Applications, doi:10.1038/s41377-019-0168-4 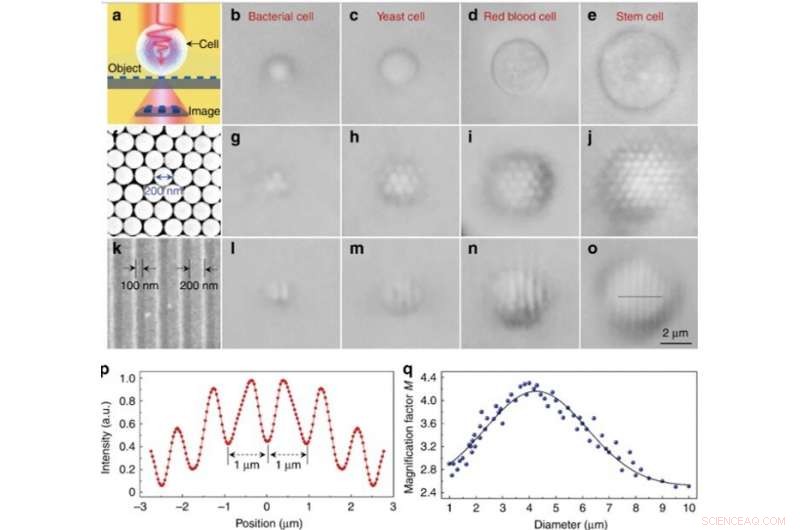
Endast nanosfärer med bioförstorare ovanpå kunde lösas upp under bildbehandling, medan nanosfärer utan biomagnifierare inte kunde lösas med ett konventionellt mikroskop. Förstoringsfaktorn M för de stamcellsbaserade biomagnifierarna bestämdes vara 3,3 gånger större (x3,3), och forskarna visade att det experimentella M berodde på bioförstoringsapparatens diameter. Senare, Li et al. utförde alla experiment med bioförstoringsapparater med denna diameter.
Nano-optisk avbildning av subcellulära strukturer och nanomönstrade bokstäver. (en, b) Optiska bilder av de subcellulära strukturerna hos en mänsklig epitelcell med användning av ett konventionellt optiskt mikroskop (a) och bioförstoringsapparater (b). Positionerna för fyra bioförstoringsapparater är markerade som A–D. För jämförelse, biomagnifierarna kan lösa upp det fibrösa cytoskelettet (indikerat som A–C) inuti cellen och tvåskiktsstrukturer (indikerat som D) på cellmembranet, som inte går att särskilja med det konventionella mikroskopet. c–e SEM (c), mörkt fält (d), och optiska bilder (e) av nanomönstrade bokstäver JNU som representerar förkortningen för Jinan University. Linjebredden på de nanomönstrade bokstäverna är 100 nm, vilket är mindre än diffraktionsgränsupplösningen för det konventionella optiska mikroskopet. f–h Optiska bilder som visar att bioförstoringsglaset som är fångat på fiberspetsen kan skanna och avbilda de nanomönstrade bokstäverna J (f), N (g), och U (h) genom att förflytta fibern. Linjebredden på de nanomönstrade bokstäverna förstorades från 100 till 400 nm. Kredit:Light:Science &Applications, doi:10.1038/s41377-019-0168-4 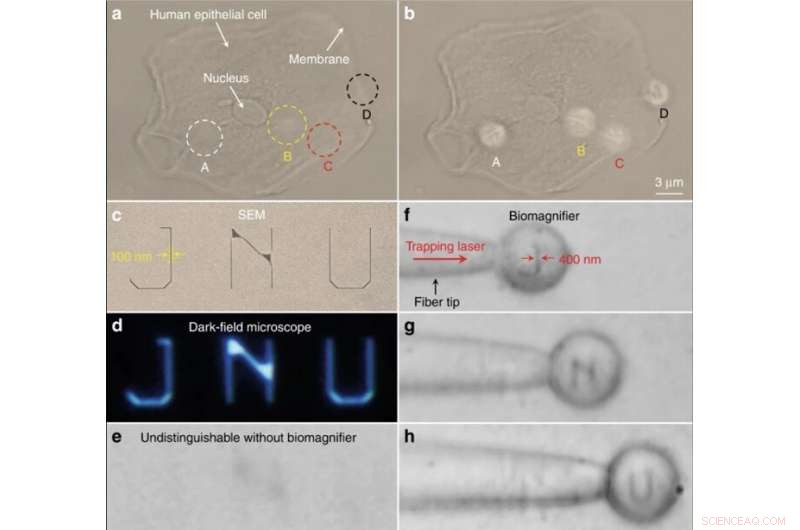
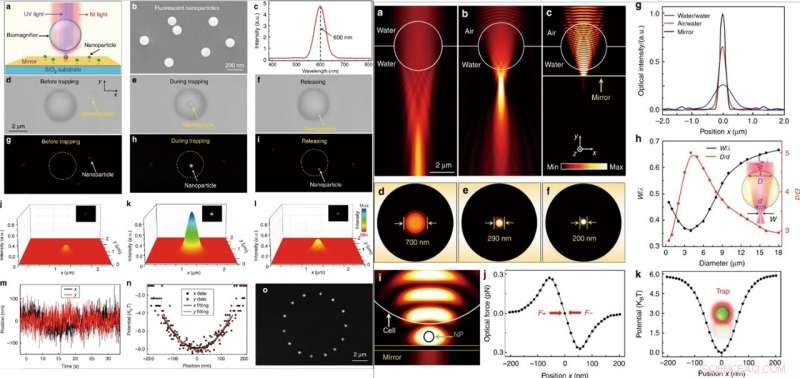
VÄNSTER:Optisk manipulation av en enda fluorescerande nanopartikel. (a) Schematiskt diagram som visar en fluorescerande nanopartikel suspenderad på ytan av en spegel och fångad av bioförstoringsapparaten. (b) SEM-bild som visar PS-fluorescerande nanopartiklar med en genomsnittlig radie på 50 nm. (c) Emissionsspektrum som visar den centrala emissionsvåglängden för de fluorescerande nanopartiklarna vid 600 nm. (d–f) Optiska bilder visar fångstprocessen för en enda PS-nanopartikel med bioförstoringsapparaten. Processen bestod av tre på varandra följande steg:före fångst (d), under fångst (e), och efter frigivning (f). g–i Fluorescensbilder som visar fluorescensfläcken av PS-nanopartikeln innan den fångas (g), under fångst (h), och efter frigivning (i). j–l Tredimensionell färgkartläggning av nanopartikelns fluorescensfläckar som visas i g–i. m Realtidsspår av positionen för den fångade nanopartikeln i x- och y-riktningarna. (n) Fångningspotential för den fångade nanopartikeln i x- och y-riktningarna med parabelbeslag. (o) Sammansatta fluorescensbilder visar rörelsespåret för den fångade nanopartikeln i x-y-planet genom kontrollerad rörelse av bioförstoringsapparaten. HÖGER:Numerisk simulering och beräkning. (a–c) Optiska intensitetsfördelningar av ljusfokusering av en 4-μm bioförstoringsapparat helt nedsänkt i vatten (a), halvt nedsänkt i vatten (b), och upphängd på ytan av en spegel (c). Belysningsljuskällan var inställd som en Gaussisk stråle med en våglängd på 560 nm. (d–f) Optiska intensitetsfördelningar av ljusfläckarna från bioförstoringsapparaten motsvarande (a–c) i x–z-planet. (g) Optiska intensitetsprofiler vid fokalplanen för det utgående ljuset från bioförstoringsapparaterna i x-riktningen. (h) FEM-simuleringsresultat för den normaliserade midjan av ljusfläcken w/λ (w är midjeradien för ljusfläcken och λ är våglängden för ingångsljuset) och förhållandet D/d (bredden av det linjära området där ljus kommer in i bioförstoringsapparaten vid dess främre yta kallas D, och bredden av den utgående ljusstrålen vid den bakre ytan är (d) som en funktion av bioförstoringsapparatens diameter. (i) Simulerad intensitetsfördelning av nära-infrarött fångstljus som visar att en nanopartikel (radie:50 nm) fångas i gapet mellan bioförstoringsapparaten och spegeln. Den optiska ineffekten för fångstljuset var inställd på 10 mW. (j) Simulerade optiska krafter hos nanopartikeln fångade i ljusfläcken som en funktion av nanopartikelns position längs x-riktningen. (k) Beräknad fångstpotential för den fångade nanopartikeln som en funktion av positionen längs x-riktningen. Kredit:Light:Science &Applications, doi:10.1038/s41377-019-0168-4
Därefter, när de samtidigt bestrålade nära infraröda (IR) och UV-laserstrålar på bioförstoringsapparaten genom en objektivlins, de kunde fånga och excitera nanopartiklarna. För dessa experiment, forskarna använde fluorescerande nanopartiklar med en genomsnittlig radie på 50 nm. När de fångade en enda nanopartikel i fokus för en bioförstoringsapparat, de observerade både optiska och fluorescerande bilder av provet av intresse. Li et al. beräknade sedan fångststyvheten hos partikeln i realtid med hjälp av en optisk pincett av standardtyp. Förmågan att manipulera en enda nanopartikel utan kontakt och exakt via optik kommer att vara användbar för att montera välreglerade nanostrukturer. När Li et al. numeriskt undersökt avbildningsmekanismen och fångststyvheten hos bioförstoringsapparater med hjälp av 3-D-simulering och COMSOL-mjukvara. De observerade att subdiffraktionsgränsen för ljusfokuseringsförmågan resulterade från en kombinerad "fotonisk nanojet"-effekt och koherent interferensförbättring av spegeln.
Metodens begränsningar inkluderade avbildningsavvikelse och distorsion på grund av de inhomogena intracellulära strukturerna hos den naturliga bioförstoringsanordningen, jämfört med dielektriska mikrosfärer med enhetliga brytningsindex. Lyckligtvis, intracellulära material var optiskt transparenta för synligt och nära-infrarött ljus och de optiska interaktionerna var relativt svaga inuti en enda cell. Intracellulära aktiviteter kan också ändra den partiella brytningsindexfördelningen i en cell för att orsaka ljusförvrängning under fångst och avbildning, men de flesta intracellulära aktiviteter var ultrasnabba och påverkade inte avbildningsschemat.
På det här sättet, Yuchao Li och kollegor utvecklade en ny experimentell bildteknik och verifierade de experimentella kapaciteterna med FEM-simuleringar. Li et al. integrerade optiska nanoskop och nanotweezer i en enda enhet för att avbilda och manipulera nanostrukturer samtidigt för första gången i detta arbete. De främjade upplösningen av tekniken till 100 nm och föreslog en etikettfri bildprocedur. Forskarna föreställer sig att den levande bioförstoringsapparaten öppnar nya möjligheter inom superupplösningsavbildning, realtidsavkänning och exakt nanosammansättning av bionanomaterial för att bilda nanoarkitekturer av intresse.
© 2019 Science X Network