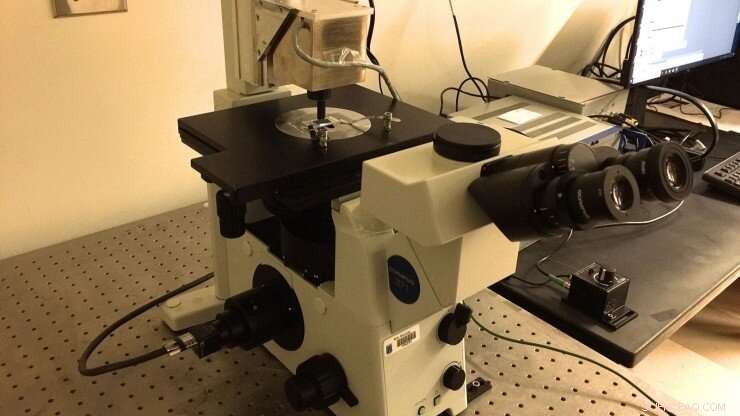
Marszalek labs nya magnetiska pincett, som byggdes enligt specifikationer som delas av professor Julio Fernandez (Columbia University). En mikrofluidkammare som är funktionaliserad med "borstar" av polyprotein avbildas med hjälp av ett nedsänkningsoljemål som matas till en CMOS -kamera. Magnetpärlor är fästa på polyproteiner för att utöva piconewton -krafter på dem genom att justera positionen för permanenta neodymium -magneter. Magneterna manipuleras med PID -enhet placerad ovanför kammaren. Upphovsman:Duke University
När det gäller rymdorganisation, DNA har krafter som konkurrerar med Marie Kondo. En DNA -sträng som är två meter lång viker sig intrikat till en cellkärna som bara är 10 mikron över. (Ett av hårstråna på ditt huvud har en diameter på 100 mikron, och du kan inte se något mindre än det utan ett mikroskop.) Allt som behöver ske biokemiskt för att DNA:t ska fungera beror på den exakta uppackningen och avvecklingen av dess strängar från det lilla utrymmet.
Men studiet av DNA och andra komplexa molekyler fokuserar ofta inte på deras mekaniska egenskaper utan på deras kemiska processer, noterade Duke maskiningenjör och materialvetenskapsprofessor Piotr Marszalek. Medan biokemisk forskning har lett till banbrytande applikationer som kloning, genterapi och genuttrycksprofilering, Marszalek sa att det intensiva fokuset på det enda området ibland har överskuggat mekanikens betydelse för att förstå förhållandet mellan molekylstruktur och funktion.
Marszalek tillhör en grupp forskare som använder enkelmolekylkraftspektroskopi (SMFS) för att studera molekylstruktur, och krafterna som stabiliserar dessa strukturer. För närvarande, det finns tre huvudmetoder för SMFS:atomkraftsmikroskopi (AFM), som skannar ytan på en molekyl med en sond på storlek av några atomer och kan mekaniskt sträcka dessa molekyler; optisk pincett, som lockar partiklar via fokuserade lasrar (och som tjänade deras uppfinnare, Arthur Ashkin, ett Nobelpris i fysik); och magnetpincett, vars dragning är så kraftfull att Marszalek varnade mig för att hantera dem, av rädsla för att min hud skulle klämmas mellan magnetcylindrarna och jag skulle hitta dem omöjliga att bända isär.
Varje tillvägagångssätt gör det möjligt för forskare att fånga en enda molekyl - som DNA, eller lite muskler eller annat protein - och sträck det långsamt för att observera vad som händer.
Det går inte bara på mitten, som du kan förvänta dig.
Polypeptidkedjor viks lokalt, Marszalek förklarade, på ett sätt som bildar små kulor. "När du först tänder ett protein, du gör en rak struktur, "sa han." Men när du drar längre, allt börjar varva ner. Du kan dra och dra utan att bryta, och i extrema fall kan en domän riva upp och erbjuda extra längd för att skydda sig själv. "
Marszalek betonade att detta inte är nyheter - i maj 1997, tre artiklar om detta ämne publicerades nästan samtidigt, en i Natur (Robert Simmons team använde optisk pincett) och två in Vetenskap (Carlos Bustamantes team använde också optiska pincetter, medan Herman Gaubs team använde AFM). Men dessa upptäckter lärde forskare mycket om hur muskler byggs, och förstärka vikten av att förstå mekanik i minsta skala.
Marszalek arbetar för närvarande med att förstå hur molekyler återställer sina former och fungerar när spänningen som utövas på dem är avslappnad. Ta eldflugeluciferas - när det är korrekt vikt, detta protein bioluminesces. När den tappar sin struktur, det blir en enkel polymer, oförmögna att producera ljus. Andra proteiner, vid samma kollaps, dra nytta av hjälp av "chaperone -enzymer" som hjälper till att återställa sin ursprungliga form. Hur de gör det, exakt, är oklart, och att lära sig mer om den mekanismen kan ge insikt i hur våra kroppar läker efter fysisk stress.
Några av Marszaleks kollegor utarbetar mekanismen för bakteriella infektioner - hur bakterier som staph kan upptäcka receptorproteiner i celler och låsa fast dem så fast att blodomloppet inte kan tvätta bort dem. Styrkan i denna obligation mättes framgångsrikt 2017 med AFM, och att upptäcka hur man löser bandet kan hjälpa till i kampen mot sådana dödliga infektioner.
I slutet av sommaren 2019, National Science Foundation finansierade en SMFS -workshop som Marszalek organiserade, vid sidan av University of Texas Medical Branch's Andres F. Oberhauser. Hålls hos Duke, workshopen sammanförde armaturerna som var pionjärer inom SMFS -tekniker för decennier sedan med yngre forskare med fokus på framtidsutsikter för kraftspektroskopi. Den intensiva agendan för sessioner och rundabord varade långt in på kvällstimmarna varje dag, när deltagarna täckte de stora prestationer som varje teknik möjliggjorde, föreslagna framtida riktningar, och funderar över vägspärrar som hindrar ytterligare framsteg.
Det var också, som Marszalek hade hoppats, ett bytesmöte för verktyg och idéer. Forskare vid University of Colorado-Boulder erbjöd molekyler som kan användas som "handtag" för att dra isär andra molekyler; en forskare från Johns Hopkins visade hur laserpincett kan användas för att fånga nysyntiserade proteiner. Marszalek själv gick därifrån med ett glänsande nytt samarbete med University of Milwaukee, vars fysiker har djup expertis med magnetpincett.
"Enstaka molekylkraftspektroskopi har uppenbarligen blivit myndig och producerat många spännande upptäckter inom mekanobiologi och mekanokemi. "sa Marszalek." Spänningen kring SMFS -tillvägagångssätt ökar stadigt, men det finns utmaningar att lösa, särskilt när det gäller att utnyttja SMFS för att studera mekaniska egenskaper och krafter inuti levande celler. När forskare utvecklar smarta tillvägagångssätt för att uppnå det målet, bara detta ämne kan vara ett tema för ett annat spännande symposium. "