
En polymer som består av ett protein tubulin, det är en komponent i cytoskelettet involverad i intracellulär transport, cellulär rörlighet och kärndelning. Kredit:AMOLF
AMOLF-forskare har presenterat en teori som beskriver friktionen mellan biologiska filament som är tvärbundna av proteiner. Förvånande, deras teori förutspår att friktionskraften skalar högst olinjärt med antalet tvärbindare. Författarna tror att celler använder denna skalning inte bara för att stabilisera cellulära strukturer, men också för att kontrollera deras storlek. De nya rönen är viktiga för förståelsen av dynamiken i cellulära strukturer som den mitotiska spindeln, som drar isär kromosomerna under celldelningen.
Motorproteiner kontra friktionskrafter
Många cellulära strukturer består av långa filament som är tvärbundna av motorproteiner och icke-motoriska proteiner (se figur). Dessa så kallade cytoskelettstrukturer ger inte bara celler deras mekaniska stabilitet, men också göra det möjligt för dem att krypa över ytor och att dra isär kromosomerna under celldelning. Kraftgenerering tillskrivs vanligtvis motorproteiner, som, använder kemiskt bränsle, kan röra filamenten i förhållande till varandra. Dock, dessa motorkrafter motarbetas av friktionskrafter som genereras av passiva, icke-motoriska proteiner. Dessa friktionskrafter är en central bestämningsfaktor för de mekaniska egenskaperna hos cytoskelettstrukturer, och de begränsar hastigheten och effektiviteten med vilken dessa strukturer formas. Dessutom, de kan till och med vara avgörande för deras stabilitet, för om motorkrafterna inte motarbetas av friktionskrafterna som genereras av de passiva tvärbindarna, strukturerna kan till och med falla isär.
Exponentiell ökning
För att förstå dynamiken i dessa cytoskelettstrukturer och de krafter de kan generera, det är viktigt att förstå hur friktionskrafterna skalas med längden på filamenten och antalet tvärbindare mellan dem. Befintliga teorier förutspår att friktionen ökar linjärt med antalet tvärbindare, vilket är vad man kan förvänta sig intuitivt. Dock, nyligen genomförda experiment har tydligt visat att friktionskrafterna skalas icke-linjärt, dvs exponentiellt, med antalet tvärbindare. På grund av covid-19-krisen, vi vet alla vilken dramatisk skillnad en exponentiell kontra linjär ökning kan göra. Ända tills nu, ursprunget till detta mycket ovanliga exponentiella skalningsbeteende för friktionen mellan filamenten förstods inte.
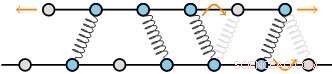
Cytoskelettstrukturer består av filament som är tvärbundna av proteiner. Dessa filament består av ett regelbundet gitter av underenheter, vilket ger en diskret uppsättning bindningsställen för tvärbindarna. Författarnas teori förutspår att, som ett resultat, friktionskrafterna skalar mycket snabbt när antalet tvärbindare ökar. Kredit:AMOLF
Förklaring
AMOLF gruppledare Ten Wolde och Ph.D. student Wierenga har nu utvecklat en teori som förklarar dessa experimentella observationer. Deras teori är baserad på observationen att biologiska filament består av ett regelbundet gitter av underenheter, vilket ger en diskret uppsättning bindningsställen för tvärbindarna. Ten Wolde och Wierenga förutspår att filamenten bara kan röra sig om länkarna omorganiserar sig kollektivt. Som ett resultat av denna kollektiva omorganisation, friktionskrafterna ökar mycket snabbt, dvs. exponentiellt, med antalet länkar.
Författarnas arbete har stora konsekvenser för vår förståelse av dynamiken i cytoskelettstrukturer. Särskilt, den exponentiella skalningen betyder att dessa strukturer i huvudsak fryser när tvärbindardensiteten överskrider en viss tröskel; friktionskrafterna blir så höga att de förhindrar ytterligare rörelse. Celler kan använda denna starka skalning för att kontrollera storleken och stabiliteten hos cellulära strukturer.